肿瘤细胞的异质性使癌症能够动态地适应进展过程中的微环境压力。然而,异质性肿瘤细胞之间的转化和细胞间通讯的机制仍然是难以捉摸的。
2024年3月28日,首都医科大学冯芝恩及韩正学共同通讯在Journal of Extracellular Vesicles 在线发表题为“The small extracellular vesicle-mediated intercellular transformation of CXCRLow to CXCRHigh tumour cells promotes the progression of head and neck squamous cell carcinoma”的研究论文,该研究报告了一个“传染模型”,介导异质肿瘤细胞之间的细胞间转化,促进肿瘤进展。该研究在头颈部鳞状细胞癌(HNSCC)肿瘤细胞中鉴定了白细胞介素-8受体CXCR1的异质表达,发现CXCR1高表达的肿瘤细胞具有更高的迁移和侵袭能力。经过白细胞介素8介导的激活,CXCR1High细胞通过分泌细胞外小泡(sEVs)将CXCR1Low细胞转化为CXCR1High细胞,从而增加了CXCR1High细胞的比例,促进了肿瘤的进展。
从机制上讲,该研究证明了来自白细胞介素8激活的CXCR1High细胞的sEVs含有高水平的ATP柠檬酸裂解酶(ACLY),该酶使NF-κB p65乙酰化,并促进其核易位,在CXCR1Low细胞中转录CXCR1。这一过程可以被Bempedoic acid(贝前列酸)(一种FDA批准的ACLY靶向药物)所抑制。综上所述,该研究揭示了sEVs介导的CXCR1Low向CXCR1High细胞的转化促进了HNSCC的进展。这为解释异质性肿瘤细胞的动态变化提供了一种新的范式,并确定了贝前列酸作为治疗HNSCC的潜在药物。

头颈部鳞状细胞癌(HNSCC)是一种常见的癌症类型,对患者造成巨大的生理和心理伤害。迄今为止,尽管使用了靶向治疗,但HNSCC的结果仍然令人不满意。越来越多的证据表明,HNSCC细胞的异质性与其治疗失败密切相关。异质性作为癌症的标志,已被证明处于动态变化状态,有助于满足肿瘤快速生长的需求。最近的研究发现,在异质性肿瘤细胞群中,具有更活跃恶性行为的肿瘤细胞最终成为多数,并在肿瘤微环境(TME)促进肿瘤进展过程中形成显性亚群。然而,主要亚群是如何形成的,以及这一过程背后的潜在机制仍然未知。
新出现的证据表明,异质性肿瘤细胞可以通过细胞间信号传导相互影响并促进肿瘤的进展。细胞外小泡(sEVs)作为细胞间物质运输的信使,在这一过程中起着至关重要的作用。sEVs作为细胞分泌的产物,携带大量的生物活性物质,包括蛋白质、脂质和核酸,并且sEVs的含量受到产生它们的细胞类型的高度调节。因此,sEVs拥有来自异质细胞的重要生物学信息,可以重塑TME并促进肿瘤进展。在这种情况下,sEVs在细胞间通讯诱导的肿瘤进展中的作用值得深入研究。
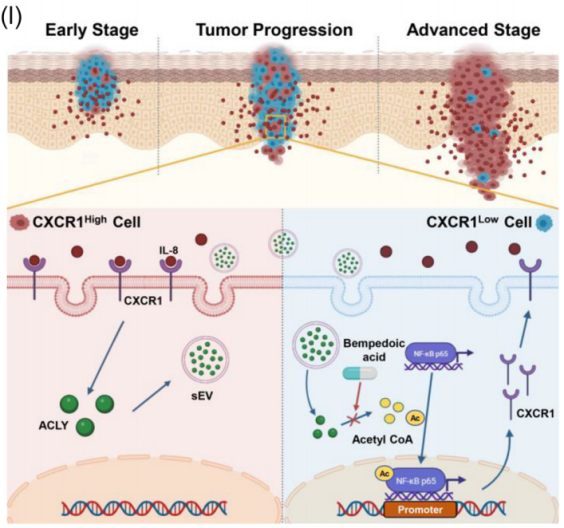
肿瘤进展过程中CXCR1High细胞比例增加(图源自Journal of Extracellular Vesicles )
在这里,作者提出了一个“传染模型”,该模型通过sEVs介导的异质肿瘤细胞之间的细胞间通讯来解释肿瘤细胞优势亚群的形成。该研究发现IL-8受体C-X-C基元趋化因子受体1 (CXCR1)在HNSCC肿瘤细胞中的异质表达,并表明CXCR1High细胞具有更高的迁移和侵袭能力。此外,在IL-8介导的激活下,CXCR1High细胞将CXCR1Low细胞转化为CXCR1High细胞,并最终成为促进肿瘤进展的优势亚群。
机制上,来自IL-8激活的CXCR1High细胞的sEVs携带ATP柠檬酸裂解酶(ACLY)进入CXCR1Low细胞,使核因子κB (NF-κB) p65乙酰化,从而促进其核易位和随后的CXCR1转录。重要的是,这一过程可以被贝前列酸(BA)抑制。该研究不仅揭示了ACLY促进CXCR1表达的潜在分子机制,更为理解异质肿瘤细胞间的通讯及其对肿瘤进展的影响提供了新的方向,并证明BA是治疗HNSCC的潜在靶向药物。
原文链接:
https://isevjournals.onlinelibrary.wiley.com/doi/full/10.1002/jev2.12427