肺动脉高压(PAH)是一种隐匿性和致死性的心肺血管疾病,其特征是肺动脉压力进行性升高及肺血管重塑。先前研究证实,TGF-β/BMP两大信号通路在肺动脉高压发病机制中具有十分重要的作用。当前最主要治疗PAH的药物主要靶向调控内皮素途径、前列环素途径和一氧化氮(NO)三大经典通路。阐明肺动脉高压发病过程中BMP/TGF-β两大信号通路的失衡机制并寻找新的分子干预靶标具有重要的临床意义!
BRCC3是由BRCC3基因所编码的JAB1/MPN/Mov34金属酶结构域(JAMM)类去泛素化酶家族的一个重要成员。BRCC3发挥去泛素化酶活性,通过调节底物蛋白K63位点连接泛素化修饰反应来调控细胞内多种信号通路,从而参与DNA损伤反应、细胞内蛋白质转运以及NF-κB通路、TNF-α受体、NOD样受体等细胞内信号转导过程。然而,BRCC3是否会影响BMP/TGF-β通路及参与缺氧诱导的肺血管重构及PAH形成尚未见报道。
2024年4月1日,扬州大学附属医院沈慧博士、龚开政教授等在Circulation上发表题为“BRCC3 Regulation of ALK2 in Vascular Smooth Muscle Cells: Implication in Pulmonary Hypertension”的研究论文,首次揭示了去泛素化酶BRCC3可通过去泛素化修饰调节BMP信号通路I型受体ALK2来激活BMP通路,同时拮抗TGF-β通路的活化,从而促进BMP/TGF-β通路失衡的恢复来防治PAH的发生与发展,为后续开发有效的肺动脉高压临床治疗药物提供全新的思路。

首先,该团队通过分析特发性肺动脉高压(IPAH)患者的肺组织和肺动脉平滑肌细胞(PASMCs)的GSE数据库,采用Sugen5416联合低氧构建经典的肺动脉高压的大、小鼠模型,检测肺组织的BRCC3蛋白的表达情况。结果表明,在各种PAH模型中,BRCC3蛋白表达水平明显下调。
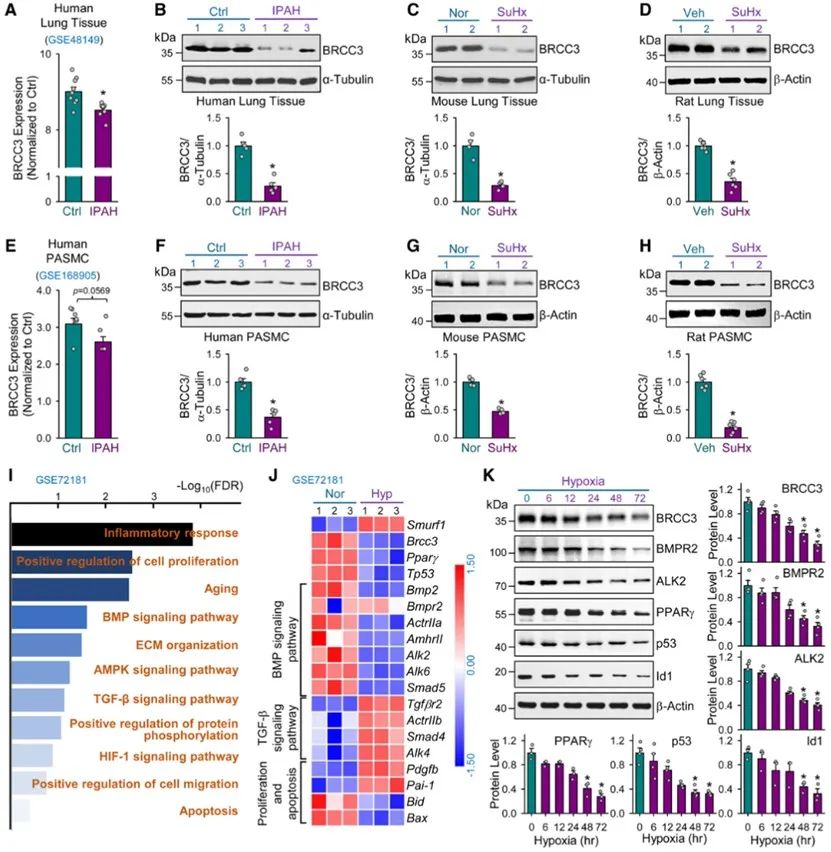
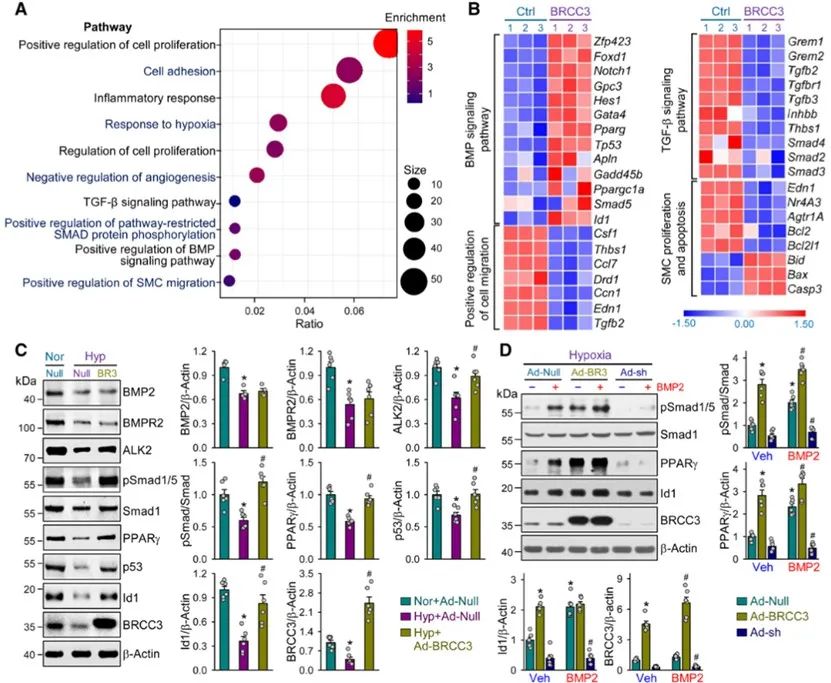
通过对肺动脉平滑肌细胞的RNA-seq分析发现,BRCC3过表达可显著激活并上调BMP信号通路,且影响增殖、迁移和凋亡相关通路。而采用腺病毒介导的BRCC3过表达则可显著上调ALK2表达,并激活BMP下游信号通路。有趣的是,与BMP信号通路完全相反,过表达BRCC3可显著抑制TGF-β-Smad2/3通路的活化。这一结果提示,BRCC3有助于调控肺动脉高压时BMP/TGF-β两条通路的失衡。
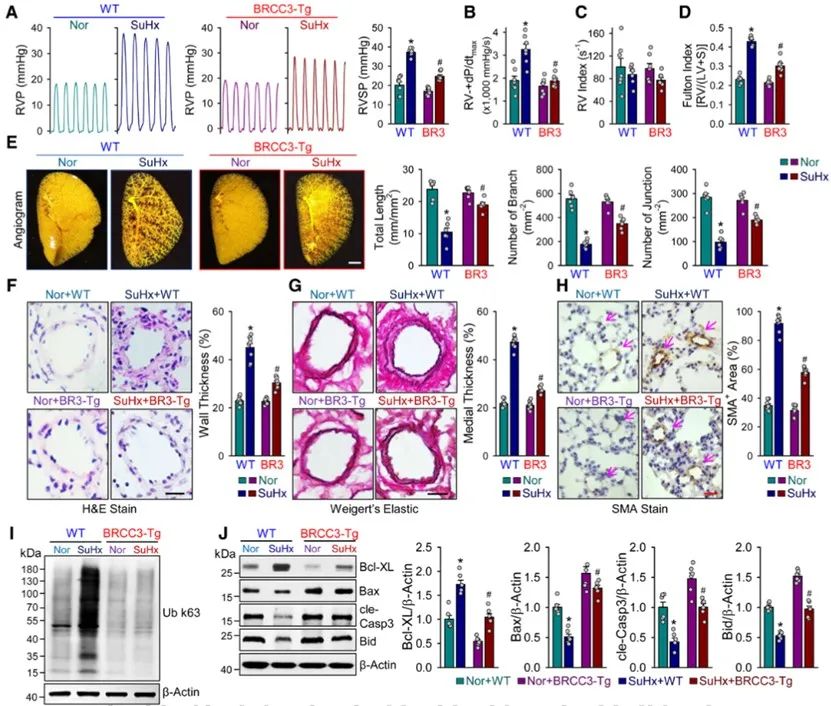
随后,研究团队成功构建了平滑肌细胞特异性过表达BRCC3的转基因小鼠(Tg)研究发现,与野生型对照(WT)小鼠相比,肺动脉平滑肌细胞过表达BRCC3可有效改善低氧诱导的肺血管重构及PAH的发生发展。
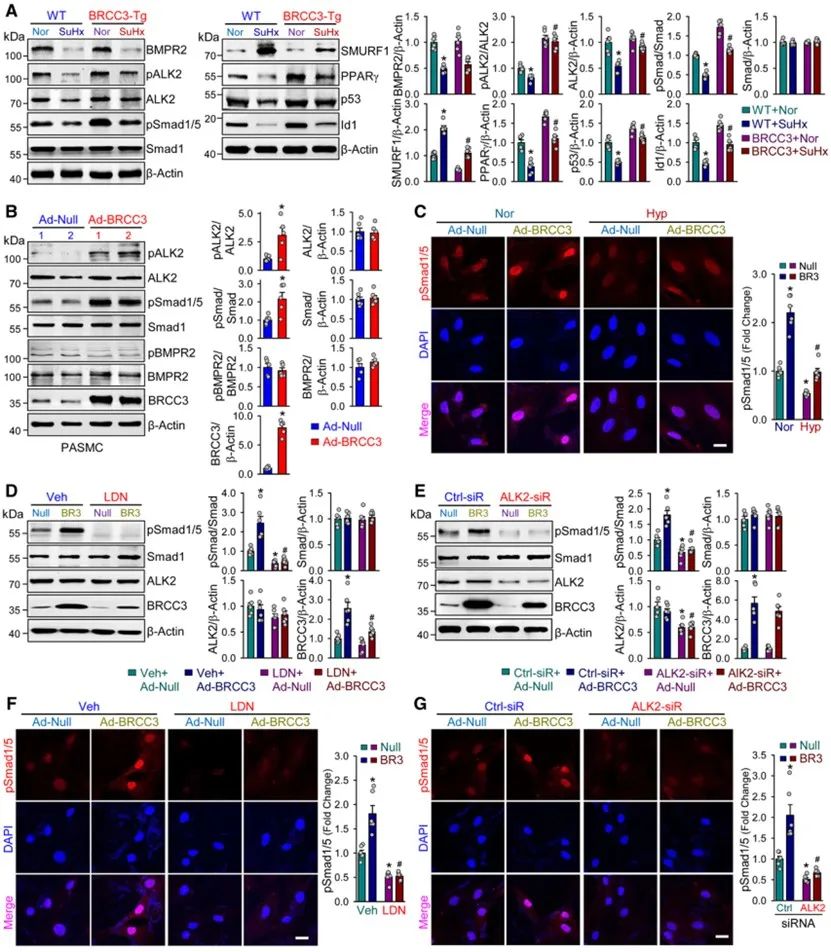
在机制上,研究证实,BRCC3过表达在常氧下即可显著上调ALK2的表达并增强其磷酸化水平,但并不影响ALK2上游的BMP受体R2的磷酸化水平。而抑制ALK2则可显著抵消BRCC3对BMP信号通路的活化效应。
围绕BRCC3调控ALK2的具体分子机制,研究人员采用多种方法证实,肺动脉平滑肌细胞内ALK2/BRCC3/SMURF1三者之间存在动态的竞争性结合机制:缺氧时,BRCC3的下调减轻了E3泛素连接酶SMURF1与ALK2的结合阻力,显著增强SMURF1介导ALK2的K48泛素化修饰,从而导致ALK2表达水平下调;而过表达BRCC3一方面可抑制SMURF1与ALK2的结合而防止ALK2发生K48泛素化修饰依赖的蛋白降解,从而上调ALK2表达,另一方面,BRCC3还可同时去除低氧诱导的ALK2的K63泛素化修饰,从而有助于增强其激酶活性来激活ALK2下游信号通路。
在上述基础上,研究团队通过生物信息学技术,进一步预测了BRCC3可能调节ALK2发生K63泛素化修饰的位点(K472和K475)。随后采取定向位点突变策略研究证实,该两个位点的突变不仅可显著导致ALK2 K63泛素化修饰水平的明显减少,而且可显著增强ALK2的磷酸化修饰及下游信号的活化。
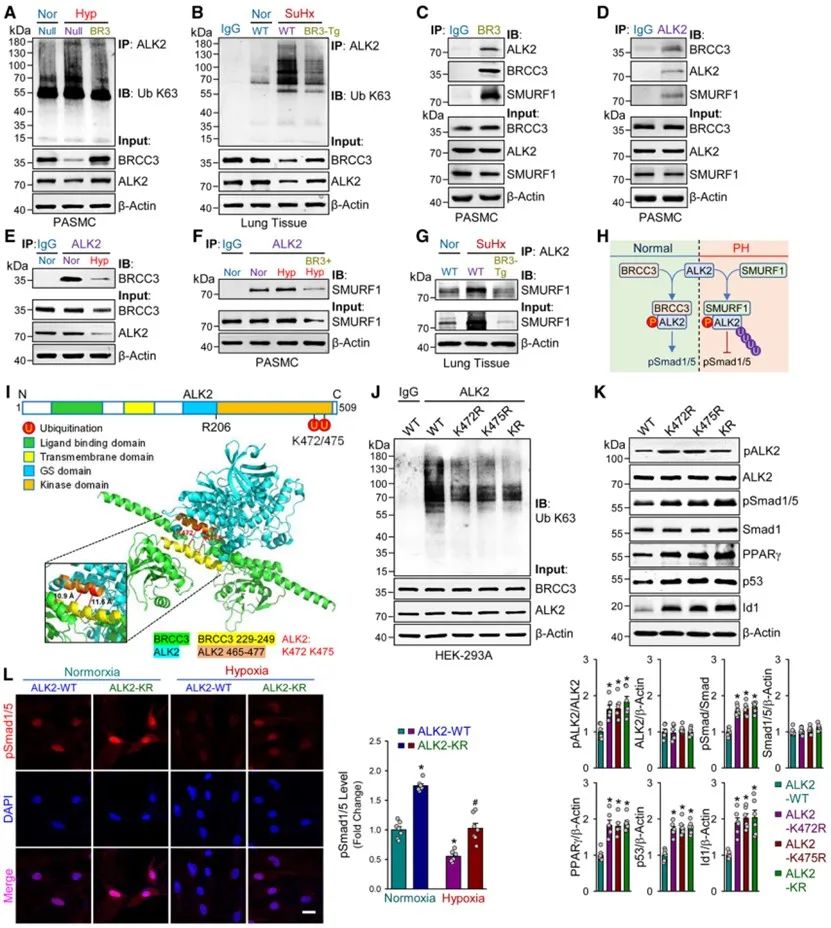
最后,研究团队通过成功构建平滑肌细胞特异性敲除BRCC3的小鼠证实:BRCC3-KO小鼠无论在常氧还是低氧下都更容易出现严重的PAH表型,而BRCC3的缺失可显著增加ALK2的K63泛素化修饰,同时下调ALK2的磷酸化水平及其下游信号,而给予PPARγ激动剂吡格列酮治疗可部分缓解BRCC3缺失诱导的肺血管重构及PAH的发展。
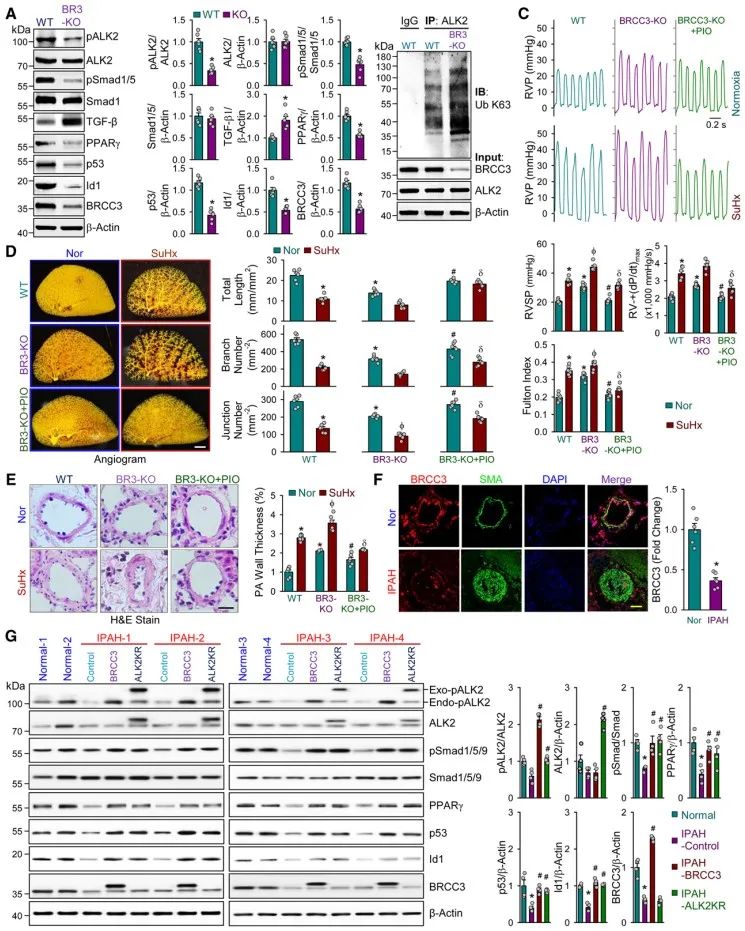
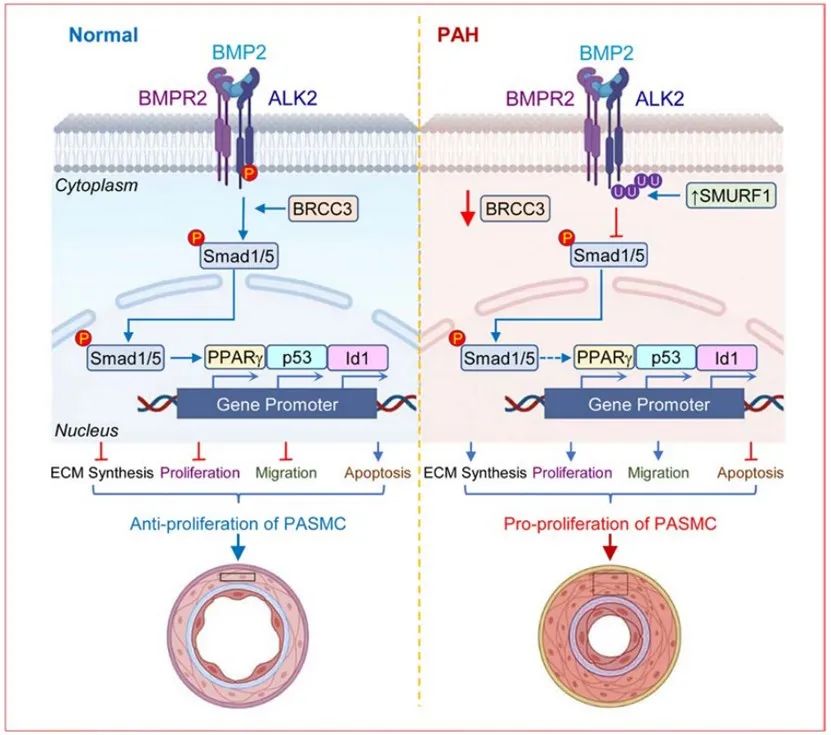
综上所述,本研究揭示了去泛素化酶BRCC3在PAH中表达降低与BMP/ALK2信号通路功能下调之间的因果关系,阐述了在肺动脉平滑肌细胞内,BRCC3通过其自身的K63去泛素化酶活性以及与SMURF1竞争结合ALK2的两种机制参与调节ALK2的泛素化水平及其激酶活性,从而正向调控BMP信号通路,负向调控TGF-β信号通路,这有利于PAH时两条主要信号通路失衡的恢复,从而调控肺动脉高压的发生发展。因此,增强BRCC3表达或活性有可能为PAH的临床防治提供一个全新的策略。
扬州大学附属医院心血管内科沈慧博士、高雅硕士为该文共同第一作者,龚开政教授、加州大学圣地亚哥分校的John Y-J Shyy、Jason X-J Yuan教授为该文的共同通讯作者。该工作还得到了香港中文大学李宗夷教授、广州医科大学第一附属医院王健教授等同道的支持和帮助!该项研究获得多项国家自然科学基金及江苏省自然科学基金的资助。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCULATIONAHA.123.066430