现阶段,肝癌治疗方案仍以抗血管生成靶向治疗或者免疫联合治疗的策略为主,然而疗效因人而异,差异化显著。在最新的NCCN肝癌临床实践指南中推荐基因检测为肝癌系统性治疗带来希望,检出RET基因融合可以指导塞普替尼靶向治疗,NTRK基因融合可以选择拉罗替尼或恩曲替尼靶向治疗,检出MSI-H/dMMR患者可以指导多斯塔利单抗的免疫治疗,而检出TMB-H可以指导纳武利尤单抗与伊匹木单抗的联合治疗方案,且无论患者是一线治疗还是后线治疗。因此,肝癌患者的基因检测也是指导靶向和免疫精准治疗的必要手段,尤其是针对晚期后线治疗的患者!

图1 摘自新版《NCCN肝癌临床诊疗实践指南》
复旦大学附属肿瘤医院的研究通过NGS多基因检测,在98.6%的肝癌患者中检出基因体细胞突变,为肝癌患者的治疗和预后管理提供着希望[1]!近期,我司为一位肝细胞癌患者检出TSC2基因截短突变,多角度指导患者的临床管理。
案 例
▶ 患者信息:男、60岁
▶ 病理诊断:肝细胞癌
▶ 送检样本:石蜡切片+对照血
▶ 检测项目:实体瘤全外显子组基因检测(组织版)
接收到样本后,通过对全外显子组全面的基因检测及生信分析,患者样本中检出TSC2、ARID1A、TP53等多个基因变异,我们重点关注TSC2 p.Arg1459*(R1459*)截短突变,变异丰度(VAF)为20.32%。TSC2基因编码蛋白是mTOR信号通路中的一种肿瘤抑制因子,在多种癌症中由于突变或缺失而失活,导致肿瘤发生发展。

图2 患者基因检测检出突变
肝癌患者常见的关键基因突变有哪些?
目前,多项临床研究证实,肝癌患者具有丰富的分子突变谱,并且通过基因检测能够指导相关靶向用药突变。上海东方肝胆医院回顾了78例术后HCC患者的NGS检测结果[2],发现肝癌中常见的基因突变有TP53(55%), TERT(37%), MUC16(29%), CTNNB1(27%), AXIN1(14%), IGFN1(14%), ARID1A(13%), FAT3(13%),PREX2(13%)和TSC2(12%)。其中,较为常见的基因共突变(频率>10%)有:TSC2+TP53/SPTA1,TERT+FAT2/FAT3,CTNNB1+MUC16/MUC16/FAT3,ARID1A+AXIN1等。结合OncoKB数据库,39(50.0%)的患者至少有一个潜在靶向用药的突变,用药证据等级为I、II、III、IV级的占比分别为26.92%、23.08%、17.95%和14.1%。31例携带DDR基因突变,提示PARP抑制剂靶向治疗的可能性。
纪念斯隆凯特琳中心(MSKCC)去年发表在JCO上的研究显示,通过NGS ctDNA液体活检,对来自51例HCC患者的53个血浆样本分析[3]。在92.2%的患者中检测到基因变异,其中,最常见的基因包括TERT启动子(57%),TP53(47%),CTNNB1(37%),ARID1A(18%)和TSC2(14%)。在37%的病例中,检出包括TSC1/2(18%),BRCA1/2(8%)和PIK3CA(8%)等可靶向治疗的突变。
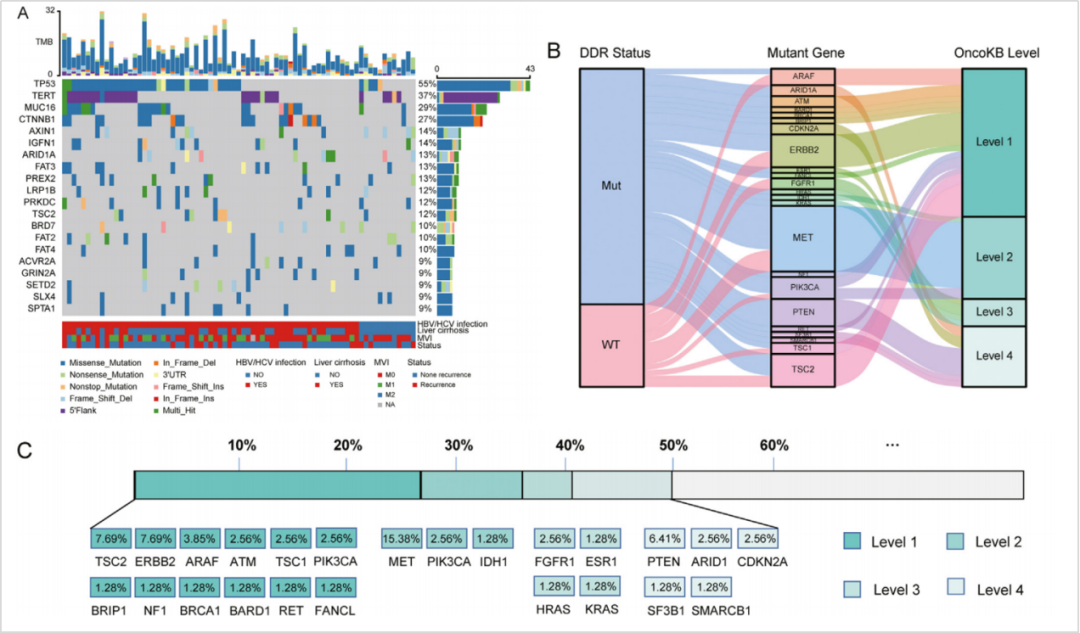
图3 肝癌常见的基因突变和用药分析
参考临床研究及数据库,基因检测能够为约一半的肝癌患者提供精准用药和预后指导。在《肝胆肿瘤分子诊断临床应用专家共识》中[4],详细介绍了肝胆肿瘤靶向治疗相关基因及免疫治疗相关分子标志物,靶向治疗相关基因包括:VEGFA,RAS,MET,TP53,FGF19,IDH1/2,PI3K/mTOR通路(PIK3CA,PTEN,STK11,TSC1,TSC2,MTOR等),HRD基因(BRCA1/2,ATM,BARD1,ATR,PALB2等),FGFR,HER2,BRAF等;免疫治疗相关分子标志物包括:PD-L1,TMB,MSI/MMR,耐药或超进展基因等。基因检测的选择上,常见的基因突变是肝癌患者基因检测需要关注的内容,而且血液标本在晚期肝癌患者中也具备重要的检测意义。
TSC2基因突变提示复发早、预后差
研究证实,TSC1/2基因属于PI3K/mTOR信号通路,基因突变会抑制mTOR的活性,可导致肝癌的侵袭能力增强,与肝癌的恶性程度呈正相关。青岛大学附属医院的回顾性研究评估了TSC2突变和肝癌1年复发率、无复发生存率和总生存期的关联[5]。研究在183例HCC患者中检出了12.6%的TSC2突变,比较分析发现,TSC2突变与HCC患者的肝旁组织微血管侵入和肝癌分化差(Edmondson分级:III-IV)显著相关,并且具有更低的无复发生存率。通过Kaplan–Meier分析,TSC2突变患者的中位无复发为7.4个月,未携带TSC2突变的患者的中位无复发生存期为30.8个月,TSC2突变的患者的RFS明显较差(p = 0.010),提示TSC2突变可能是HCC患者早期复发的潜在预测因子。

图4 TSC2基因突变与肝癌更差的预后相关
另有研究证实了上述结论[6],通过对患者为期3年的随访发现,在去除与肝癌恶化相关的其他因素影响后,TSC1/2突变的患者的远期生存率明显小于未突变患者。
文章总结道,TSC1/2基因突变对于HCC的进展具有早期评估作用,出现TSC1/2 突变的患者预后更差,检测也可以作为肝癌患者一种潜在的检查手段,临床上应针对性采取更为早期积极的治疗方案,以提升疗效。
TSC2基因突变患者如何指导后续靶向治疗?
目前,《罕见病诊疗指南》指出[7],TSC1/2基因遗传性胚系突变是结节硬化症的确诊标准,并明确指出TSC1/2基因突变的患者,包括西罗莫司和依维莫司等mTOR 抑制剂则是有效的特异性靶向治疗方法,FDA已经批准依维莫司用于治疗TSC2基因突变的管膜下巨细胞星形细胞瘤、肾血管平滑肌脂肪瘤和癫痫等多种疾病。那么携带TSC2基因突变的肝癌患者是否能同样从mTOR抑制剂中获益呢?有临床研究给出了结论。
MSKCC在携带TSC1/2基因变异的10名HCC患者中[8],对于一线索拉非尼治疗失败的4名患者,在二线时,接受了依维莫司靶向治疗,均获得疾病稳定(SD),其中有3名患者临床获益已5个月。有一名患者接受依维莫司作为一线治疗 5.0个月后疾病进展。而且,1名患有自身免疫性肝炎、Child-Pugh A 肝功能且携带 TSC2 E95*-突变型 HCC患者,使用索拉非尼治疗后疾病进展迅速,改用依维莫司治疗后疾病稳定,且肿瘤轻微缩小。
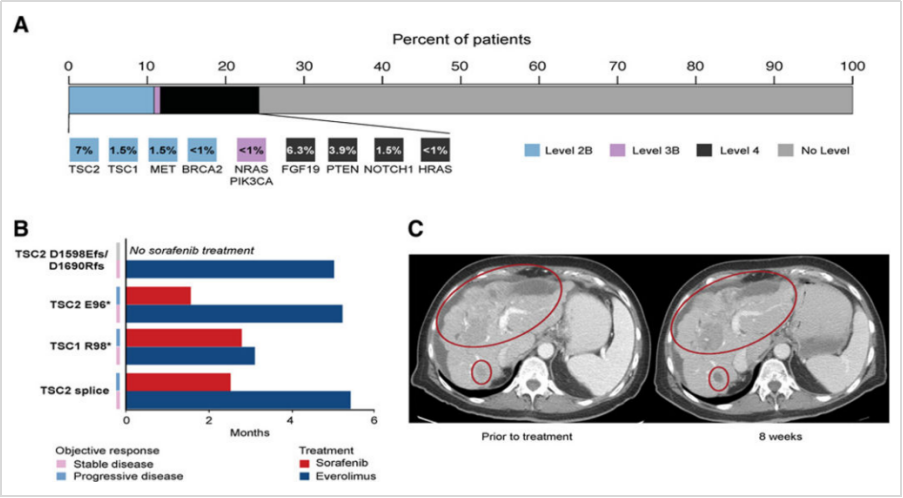
图5
A.肝癌的基因突变与靶向治疗匹配(oncokb);B.4例TSC基因突变的患者治疗史;C,TSC2 E95*突变患者用依维莫司的疗效
广东省肝病研究院回顾性研究[9],探索了TSC1/2等mTOR通路基因使突变的肝移植后肝癌患者使用西罗莫司治疗后的生存和预后。研究回顾46例肝移植后患者,基因测序结果显示10例与mTOR相关的途径突变(TSC1/2, mTOR, MAPK1, PTEN, PIK3CG和EIF4E2),其中5例(10.9%)具有TSC1/2突变,最常见。在使用西罗莫司的35例患者中,携带mTOR通路基因突变的患者的生存率明显高于没有mTOR相关突变的患者(P = 0.016)。类似的是,携带TSC基因突变患者的存活率也明显好于TSC基因未突变的患者。提示西罗莫司也是TSC突变肝癌患者的靶向药物选择。
文章解释道,由于TSC基因是mTOR信号通路的负调节剂,因此,TSC基因突变导致的表达下调将导致mTOR信号通路异常激活,进而肿瘤细胞生长增殖更为活跃,同时对西罗莫司、依维莫司等mTOR抑制剂更为敏感。
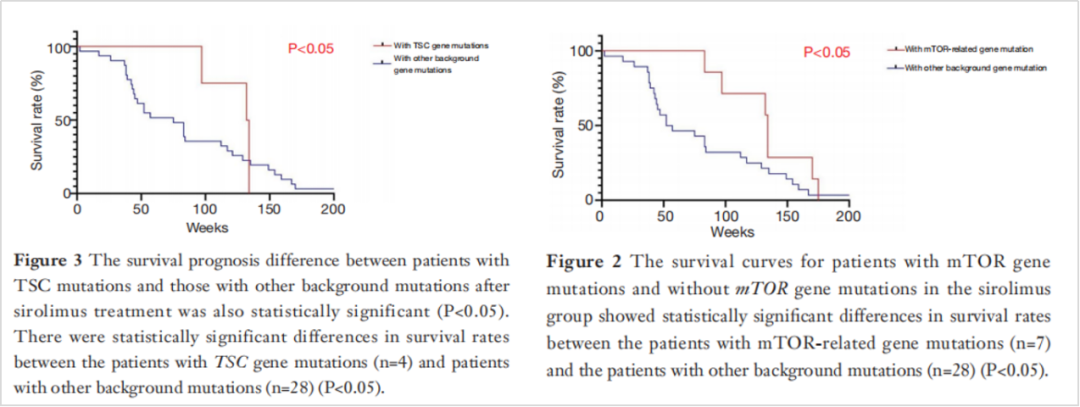
图6 TSC突变的患者更易于从西罗莫司中获益
在《西罗莫司在肝癌肝移植中应用的中国专家共识》中“西罗莫司与抗肿瘤药物联用研究进展”部分提到[10],肝癌的发生、发展与细胞中信号通路的活性改变密切相关,抑制相关信号通路已成为肿瘤靶向治疗的热点。结合抗肿瘤药物与基因靶点(PTEN、TSC1/2、KRAS、PIK3CA等)治疗肝癌肝移植受者,并以此为依据选择免疫抑制剂可使肿瘤患者得到更好的临床获益。
总结来说,本次肝癌术后的患者经过基因检测,检出关键的TSC2基因突变,为患者带来了mTOR抑制剂靶向治疗的希望,同时也提示肝癌术后易复发潜在指导价值,术后需要密切随访复查。另外,本次检测明确患者TSC突变为后天形成的体细胞突变,而非遗传相关的胚系突变,表明患者并不是结节硬化症的遗传患者,不具备家族遗传性。由此看来,肝癌患者通过基因检测指导治疗方案不应被忽视,NGS多基因检测切实为患者提供可靠的治疗机会!
参考文献:
[1]Wang L, Yan K, He X, Zhu H, Song J, Chen S, Cai S, Zhao Y, Wang L. LRP1B or TP53 mutations are associated with higher tumor mutational burden and worse survival in hepatocellular carcinoma. J Cancer. 2021 Jan 1;12(1):217-223. doi: 10.7150/jca.48983. PMID: 33391418; PMCID: PMC7738815.
[2]Yang Z, Liu J, Xue F, Zhang L, Xue H, Wu Y, Bai S, Du F, Wang X, Deng W, Song C, Wang K. Genomic landscape of Chinese patients with hepatocellular carcinoma using next-generation sequencing and its association with the prognosis. Ann Hepatol. 2023 Mar-Apr;28(2):100898. doi: 10.1016/j.aohep.2023.100898. Epub 2023 Jan 10. PMID: 36634747.
[3]Cowzer D, White JB, Chou JF, Chen PJ, Kim TH, Khalil DN, El Dika IH, Columna K, Yaqubie A, Light JS, Shia J, Yarmohammadi H, Erinjeri JP, Wei AC, Jarnagin W, Do RKG, Solit DB, Capanu M, Shah RH, Berger MF, Abou-Alfa GK, Harding JJ. Targeted Molecular Profiling of Circulating Cell-Free DNA in Patients With Advanced Hepatocellular Carcinoma. JCO Precis Oncol. 2023 Sep;7:e2300272. doi: 10.1200/PO.23.00272. PMID: 37769223; PMCID: PMC10581608.
[4]欧美同学会医师协会肝胆分会, 中国研究型医院分子诊断医学专业委员会, 中国临床肿瘤学会肝癌专家委员会, 中国预防医学学会肝胆胰疾病预防与控制专业委员会, 亚太肝病诊疗技术联盟肝癌专业委员会. 肝胆肿瘤分子诊断临床应用专家共识[J]. 临床肝胆病杂志, 2020, 36(7): 1482-1488. DOI: 10.3969/j.issn.1001-5256.2020.07.008.
[5]Song K, He F, Xin Y, Guan G, Huo J, Zhu Q, Fan N, Guo Y, Zang Y, Wu L. TSC2 Mutations Were Associated with the Early Recurrence of Patients with HCC Underwent Hepatectomy. Pharmgenomics Pers Med. 2021 Feb 16;14:269-278. doi: 10.2147/PGPM.S294307. PMID: 33623416; PMCID: PMC7896791.
[6]ZHANG Y, MAO ZF. Association of tuberous sclerosis gene 1/2 mutations with the progression of hepatocellular carcinoma and prognosis[J]. J Clin Hepatol, 2021, 37(1): 84-88. DOI: 10.3969/j.issn.1001-5256.2021.01.017.
[7]张抒扬.罕见病诊疗指南:2019年版[M].人民卫生出版社,2019.
[8]Harding JJ, Nandakumar S, Armenia J, Khalil DN, Albano M, Ly M, Shia J, Hechtman JF, Kundra R, El Dika I, Do RK, Sun Y, Kingham TP, D'Angelica MI, Berger MF, Hyman DM, Jarnagin W, Klimstra DS, Janjigian YY, Solit DB, Schultz N, Abou-Alfa GK. Prospective Genotyping of Hepatocellular Carcinoma: Clinical Implications of Next-Generation Sequencing for Matching Patients to Targeted and Immune Therapies. Clin Cancer Res. 2019 Apr 1;25(7):2116-2126. doi: 10.1158/1078-0432.CCR-18-2293. Epub 2018 Oct 29. PMID: 30373752; PMCID: PMC6689131.
[9]Wei J, Ye L, Song L, Tang H, Zhang T, Fu B, Zhang Y, Yang Q, Yang Y, Yi S. TSC1/2 mutations-a unique type of mutation suitable for liver transplantation of Hepatocellular carcinoma. J Gastrointest Oncol. 2021 Jun;12(3):1074-1085. doi: 10.21037/jgo-20-378. PMID: 34295558; PMCID: PMC8261316.
[10]中国医师协会器官移植医师分会肝移植学组, 中华医学会器官移植学分会肝移植学组. 西罗莫司在肝癌肝移植中应用的中国专家共识(2020版) [J] . 中华消化外科杂志,2020,19 (06): 589-597. DOI: 10.3760/cma.j.cn115610-20200513-00349.
