抗CD19嵌合抗原受体(CAR)T细胞用于治疗复发/难治性B淋巴母细胞白血病(B-ALL)。而面对CAT-T治疗,肿瘤可能通过靶抗原丢失,以及在KMT2A4或ZNF384重排的B-ALL中出现转换为髓系细胞,形成免疫逃逸。
近日,由 Vinodh Pillai 团队发表于 Am J Hematol 题为 Transdifferentiation of B-lymphoblastic leukemia to histiocytic sarcoma after immunotherapy 的文章。文章报告了一例B-ALL经免疫调节治疗后转分化为组织细胞肉瘤的病例。该患者经过多次治疗后,出现了CD19+ B-ALL的复发,并发生了转移。患者接受了抗CD19 CAR T细胞治疗,但在治疗后出现了转分化为组织细胞肉瘤的情况。这表明B-ALL克隆转分化为组织细胞肉瘤,暗示转分化为肉瘤是B-ALL逃避免疫治疗压力的一种新机制。

一名8岁女孩,最初被诊断为B-ALL,并接受了COG AALL0932方案治疗。在维持治疗期间,她出现了骨髓和中枢神经系统的复发。她接受了AALL1331方案治疗和骨髓移植,但又出现了复发。NGS检测发现她有NRAS基因突变。她接受了三次CD19靶向CAR T细胞治疗,但在接下来的两年中持续MRD阳性。她的肿瘤在胰腺、胃、肝脏和肾脏中扩散,经CD19靶向CAR T细胞治疗和PD-1抑制剂治疗后,她的病情得到了缓解(图1A)。
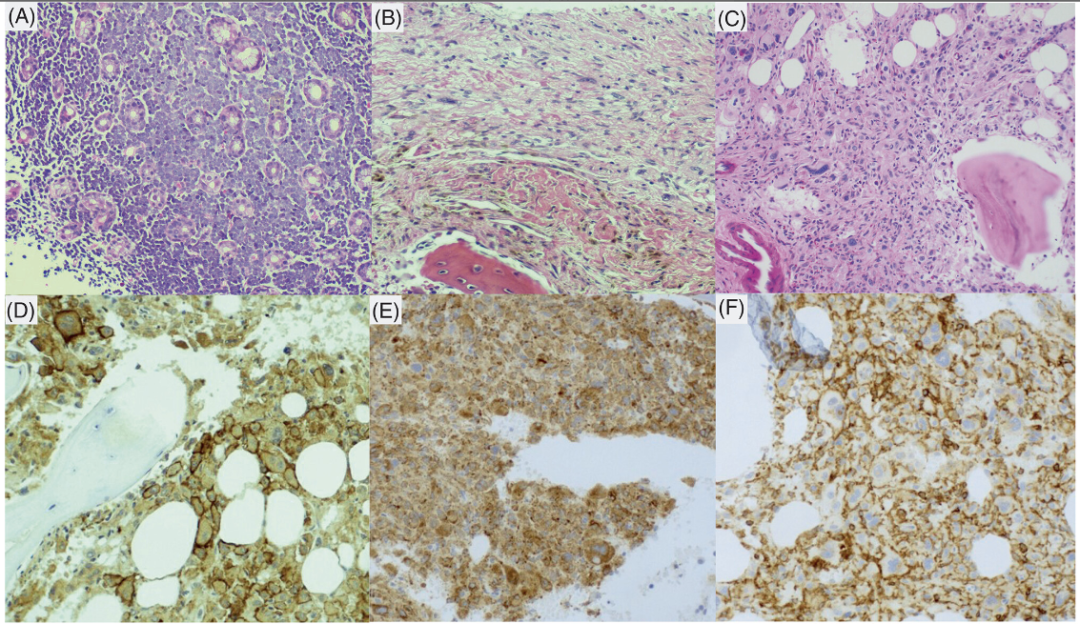
1A:患者肝脏中的CD19+B-ALL扩散病变。1B:CAR T细胞治疗后,患者骨膜内的非典型CD68阳性细胞集合体。1C:患者骨髓活检中组织细胞肉瘤浸润的不同程度。1D:组织细胞肉瘤浸润区域CD43的免疫组化染色。1E:组织细胞肉瘤浸润区域CD68的免疫组化染色。1F:组织细胞肉瘤浸润区域CD4的免疫组化染色。
CAR T细胞治疗一个月后,骨髓活检和流式细胞术显示B-ALL阴性,但在骨膜内有一个微小的(<1%)非典型CD68阳性细胞集合体(图1B)。随后的骨髓活检显示有不规则核膜、突出核仁和嗜酸性胞质的大小不一的细胞浸润(图1C),免疫组化染色显示浸润为CD43(图1D)、CD45和CD68(图1E)阳性,部分细胞表达CD4(图1F)和CD163,但阴性为CD19等。这些结果表明患者出现了组织细胞肉瘤。
在随访中,免疫组化和MRD流式细胞术未检测到残留/复发的B-ALL。然而,Adaptive Biotechnologies Clonoseq NGS MRD检测到了与B-ALL相同的IgH、IgK和IgL序列(图1G),随着组织细胞肉瘤的增加,序列数目也增加(从0.001%到0.01%)。一个追踪IgH序列在肉瘤样本中丢失,这可能是转分化的结果(图1H)。这些分子结果证实了B-ALL细胞克隆向组织细胞肉瘤的转分化。患者在随访期间失去联系并去世。
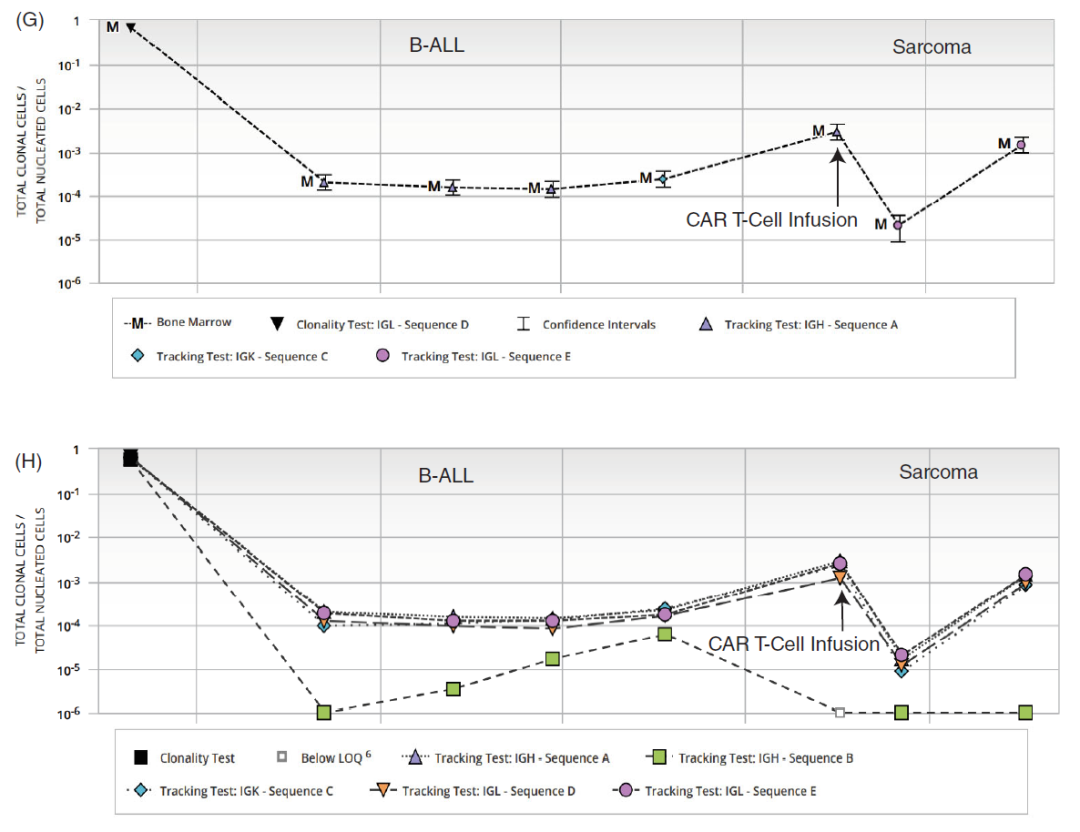
1G:Clonoseq NGS MRD检测结果,证实了B-ALL细胞克隆向组织细胞肉瘤的转分化。1H:肉瘤样本中丢失的追踪IgH序列。
转分化是肿瘤治疗逃逸的一种手段,成熟B细胞淋巴瘤在CAR-T细胞治疗后偶尔会发生,但在B-ALL中尚未报道。少数B-ALL转分化为克隆相关的组织细胞肉瘤,也曾在高剂量环磷酰胺、长春新碱、阿霉素和地塞米松治疗后报告过。由于该肿瘤接受了多轮化疗和免疫治疗,很难确定诱导细胞系转换的治疗方法。然而,由于免疫调节治疗与组织细胞肉瘤的发生时间有关,因此可能存在免疫调节治疗在促进转变方面的作用。
NRAS基因突变的作用值得关注,因为MAPK和RAS通路突变通常与组织细胞肿瘤有关。NRAS背景可能在转变为组织细胞肉瘤方面发挥了作用。有趣的是,PIK3、MAPK和KRAS通路也与成熟B细胞淋巴瘤CAR-T细胞治疗后失去B细胞程序有关。FLCN和POT1是仅在组织细胞肉瘤中检测到的额外突变,而不是在B-ALL中检测到的。它们通常出现在非造血性肿瘤中,也可能在转分化中发挥了作用。总之,本论文显示转分化为肉瘤是B-ALL逃避免疫治疗压力的一种新机制。