大B细胞淋巴瘤患者中有20-30%在标准一线化疗免疫治疗(CIT)后会复发,10-15%对CIT无反应,对于这部分患者,二线治疗一直是一个挑战。虽然高剂量化疗联合自体造血干细胞移植(HSCT)可以治愈部分患者,但对于化疗耐药的患者,尤其是初治后未达到完全缓解的患者,移植结果较差,对于那些不适合移植的患者,没有统一标准的二线治疗方案,部分较弱的方案,如吉西他滨或苯达莫司汀为基础的方案,或他法西他单抗联合来那度胺,可以考虑,但通常是姑息性的,在2022年4月,FDA批准了阿基仑赛用于一线CIT失败或一年内复发的成人大B细胞淋巴瘤患者,这一批准标志着二线治疗标准的转变。liso-cel是一种靶向CD19抗原的细胞免疫治,2022年6月,FDA扩大了liso-cel的适应症,用于一线CIT失败或一年内复发的大B细胞淋巴瘤患者,以及不适合HSCT的患者,这一扩展适应症的批准是基于两项临床试验的结果,该文章介绍了支持Liso-cel二线适应症的两个关键临床试验TRANSFORM和PILOT。

方法
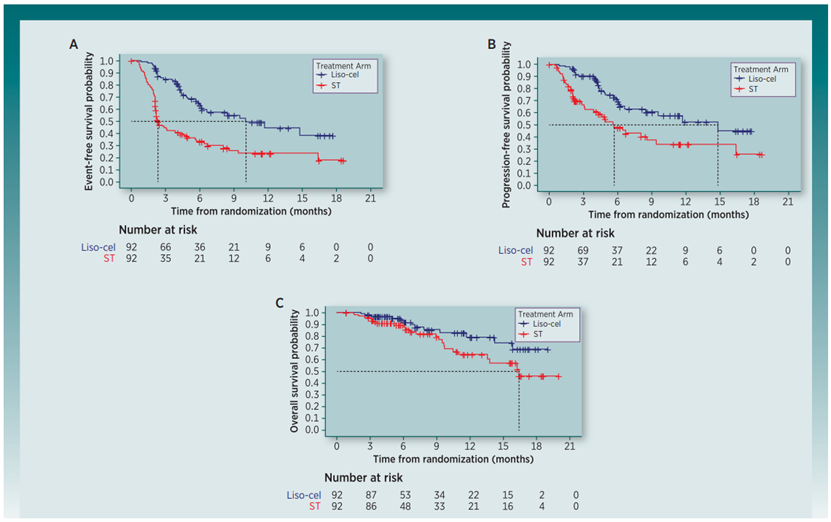
TRANSFORM临床试验:这是一项随机、开放标签、多中心的3期临床试验,在184例符合自体HSCT条件的大B细胞淋巴瘤患者中进行了liso-cel单次输注和标准治疗的比较,标准治疗包括铂类为基础的CIT三周期,随后在达到至少部分缓解的患者中进行高剂量化疗和自体HSCT,主要终点是事件无进展生存期(EFS)。
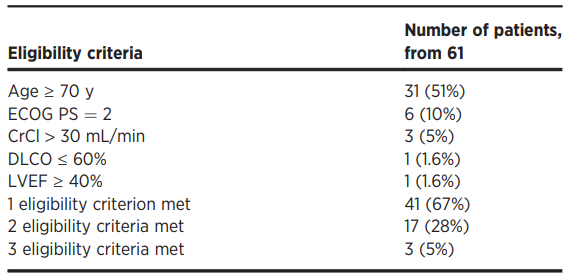
PILOT临床试验:这是一项单臂、开放标签、多中心的2期临床试验,在61例不适合高剂量化疗和自体HSCT的患者中进行了liso-cel单次输注,这些患者因年龄或并发症不适合移植,但仍有足够器官功能进行CAR T细胞治疗,主要终点是总响应率(ORR)。
研究结果
TRANSFORM临床试验:在中期分析中,liso-cel组的EFS显著优于标准治疗组,危险比(HR)为0.34(95%CI, 0.22-0.51; P<0.0001),liso-cel组的估计中位EFS为10.1个月,而标准治疗组为2.3个月,liso-cel组的完全缓解率(CR)显著高于标准治疗组,为66% vs 39%,差异为27%(95%CI, 12-41%; P<0.0001),liso-cel组的进展无进展生存期(PFS)也显著优于标准治疗组,中位PFS分别为14.8个月和5.7个。在liso-cel组,最常见的副作用是发热(55%)、细胞因子释放综合征(CRS)(49%)、肌肉骨骼痛(36%)、头痛(34%)和疲劳(28%)。
PILOT临床试验:在61例接受liso-cel的患者中,IRC评估的ORR为80%,CR率为54%,在达到CR的33例患者中,估计的持续缓解率为68%。最常见的副作用是疲劳(44%)、CRS(39%)和发热(38%)。

结论
在符合HSCT条件的患者中,liso-cel相比标准治疗显著提高了EFS和PFS,以及CR率,表明liso-cel具有显著的临床获益,在不适合HSCT的患者中,liso-cel取得了较高的CR率和持久的缓解,为这部分患者提供了临床意义,liso-cel的安全性与晚期线治疗相似,已知的安全事件可以得到良好的控制,整体风险效益比良好。liso-cel作为大B细胞淋巴瘤的二线治疗,在符合HSCT条件的患者以及不适合HSCT的患者中均显示出良好的风险效益比,因此,基于liso-cel在二线治疗中表现出的显著临床获益和整体良好的风险效益比,FDA批准了其用于大B细胞淋巴瘤的二线治疗。
原始出处
Mona Elmacken, Helkha Peredo-Pinto, Cong Wang, Zhenzhen Xu, Million Tegenge, Adnan A. Jaigirdar, Marc R. Theoret, Tejashri Purohit-Sheth, Yvette L. Kasamon; FDA Approval Summary: Lisocabtagene Maraleucel for Second-Line Treatment of Large B-Cell Lymphoma. Clin Cancer Res 2024.