核酸药物目前已广泛应用于生物医学领域。然而,其在体内的主要挑战之一是如何选择性地将核酸药物递送至亚细胞区室。
为了解决这个问题,暨南大学戴箭副研究员等人设计构建了一种类溶瘤病毒纳米颗粒OV@FN,可以响应肿瘤的微酸性环境通过膜融合的方式将核酸直接递送至细胞质。OV@FN由纳米核心NA-Zn@G和杂化膜囊泡(FN)组成,其中纳米核心可响应肿瘤细胞细胞质中的高浓度谷胱甘肽以准确地释放核酸,而FN则高表达溶瘤病毒融合膜糖蛋白(mVSV-G)。研究结果表明OV@FN与正常细胞相比,可有效且选择性地将核酸递送至肿瘤细胞的细胞质。更重要的是,FN有效诱导肿瘤细胞形成合胞体(syncytium),从而促进细胞内药物扩散,增强基因治疗效果。因此,OV@FN为设计基因递送和肿瘤治疗平台提供了一种新方法。相关工作以“Oncolytic Virus-Like Nanoparticles for Tumor-Specific Gene Delivery”为题发表在Advanced Functional Materials。

【文章要点】
水泡性口炎病毒(VSV)是一种具有包膜糖蛋白的非致病性负链RNA溶瘤病毒。它可在肿瘤内独特地复制,有效地发挥其肿瘤杀伤作用。VSV具有典型的负链RNA病毒结构,由融合糖蛋白,基质蛋白和核衣壳组成。在这些成分中,水泡性口炎病毒糖蛋白(VSV-G)可以在4.8至6.4之间的酸性pH范围内启动融合,促进内体逃逸,并随后将VSV的遗传物质释放到细胞质中以发挥其溶瘤作用。然而,潜在的神经毒性以及在体内停留时间短,都会影响VSV的溶瘤效果。为了解决这些局限性,研究人员经常对VSV进行基因修饰,以增强其抗肿瘤免疫反应,同时抑制身体的抗病毒免疫反应。不幸的是,解决VSV局限性带来的各种挑战是一项复杂的任务,无法通过单一策略来解决。因此,迫切需要开发创新方法,以规避这些缺点,通过协同作用增强靶向肿瘤杀伤并刺激强大的抗肿瘤免疫应答。为此,受VSV感染和溶瘤机制的启发,作者开发了类溶瘤病毒纳米载体,可以有效加载核酸药物并选择性靶向肿瘤细胞以响应弱酸性肿瘤微环境(TME)并启动融合活性。首先,核酸药物与锌离子结合形成纳米颗粒(NA-Zn)。为了防止核酸的降解,用5′-鸟苷一磷酸(GMP)包裹NA-Zn形成阴离子纳米粒子(NA-Zn@G)。这些纳米颗粒与受蛋白质外壳保护的病毒基因组非常相似。此外,作者还将293T-mVSV-G的细胞膜与B16-F10细胞的细胞膜以1:1的质量比混合以产生融合杂化膜(FN)。FN上表达的突变mVSV-G(具有H162R突变)可直接介导OV@FN和TME(pH值范围为6.5至7.1)中的肿瘤细胞的膜融合。最后,NA-Zn@G用FN包被以形成类溶瘤病毒纳米颗粒OV@FN(图1)。
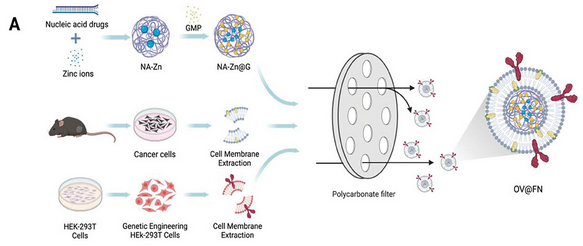
图1 OV@FN
静脉注射后OV@FN,FN表面的同源靶向配体和mVSV-G可促进OV@FN在肿瘤部位积聚并输送NA-Zn@G通过膜融合进入肿瘤细胞的细胞质。之后,NA-Zn@G在高浓度谷胱甘肽(GSH)(10 mm)的作用下,在肿瘤细胞的细胞质中释放核酸药物,发挥基因沉默的作用。对于正常组织和器官,由于正常细胞的细胞质中没有类似TME的微酸性环境,并且GSH浓度低(1 mm),因此核酸药物不能释放到细胞质中,这大大提高了其生物安全性。此外, OV@FN与肿瘤细胞膜的融合赋予了肿瘤细胞融合能力。因此,肿瘤细胞可以相互融合形成合胞体。合胞体的形成可以通过促进核酸药物在肿瘤细胞之间的释放和扩散来进一步增强核酸药物的功效。合胞体裂解后释放的肿瘤相关抗原和FN上表达的mVSV-G可以极大地促进树突状细胞的抗原识别和呈递,然后引发强烈的抗肿瘤免疫应答(图2)。体内基因沉默试验表明OV@FN具有显着的核酸递送性能,而在黑色素瘤模型中OV@FN显示出了显著的肿瘤消融能力,并改善了肿瘤部位的免疫抑制微环境。
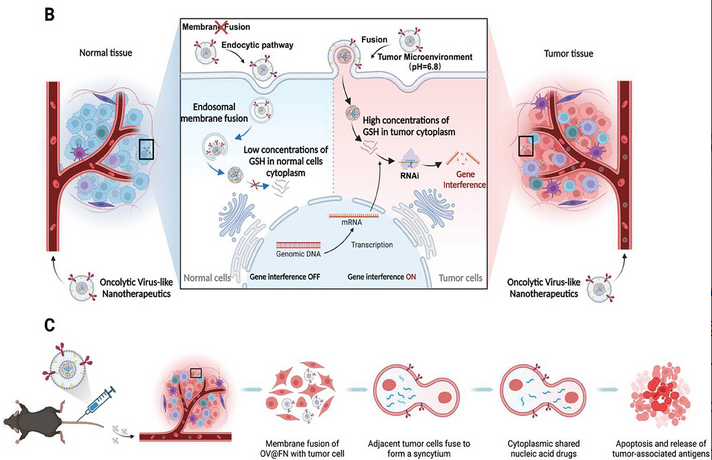
图2 基因递送及抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202314898