虽然基于祖细胞的心肌细胞再生在修复受损心脏方面具有很大的希望,但原代心肌祖细胞(CPs)在培养中的寿命有限,阻碍了其在体外和体内研究中的应用。重庆医科大学检验医学院的范家铭教授和芝加哥大学医学中心的Hue H. Luu教授团队在本刊发表了题为“SV40 large T antigen-induced immortalization reprograms mouse cardiomyocyte progenitors with mesenchymal stem cell characteristics and osteogenic potential”的研究快讯,通过SV40大T抗原(SV40 LTA)诱导,使小鼠CPs具有间充质干细胞特性和成骨潜能,为心肌细胞再生提供了新的研究方向。
1. 研究方法
本文使用SV40 LTA诱导小鼠CPs永生化,评估永生化CPs(iCPs)的间充质干细胞(MSC)特性和成骨潜能。首先通过表达SV40 LTA,将原代CPs转化为可长期增殖并表达心肌分化标记物的iCPs,使用CRE介导的SV40 LTA去除实验验证SV40 LTA对iCPs永生化表型的依赖性。通过BMP9刺激iCPs,评估其MSC特性和成骨分化能力。通过基因表达和骨钙化染色等实验,评估iCPs是否能发生成骨分化。最后,通过移植到动物体内并进行组织学分析,确认异位骨的形成。
2. 研究结果
研究结果显示,当iCPs细胞被有效转导Ad-CRE后,细胞的存活数量显著减少,证明了CRE介导的SV40 LTA去除会降低iCPs细胞的增殖活性和存活能力。此外,在BMP9刺激下,iCP细胞的碱性磷酸酶活性显著上调,表明iCPs细胞具有间充质干细胞特性并且能够发生成骨分化。动物实验证实了SV40 LTA永生化的小鼠心肌祖细胞能够在BMP9刺激下进行有效的成骨细胞谱系特异性分化,即iCPs细胞在体内能够形成异位骨。此外,研究发现BMP9诱导的成骨分化可以参与成骨调节因子Runx2和OSX的上调、iPSC因子的下调和心肌细胞的分化(图1)。
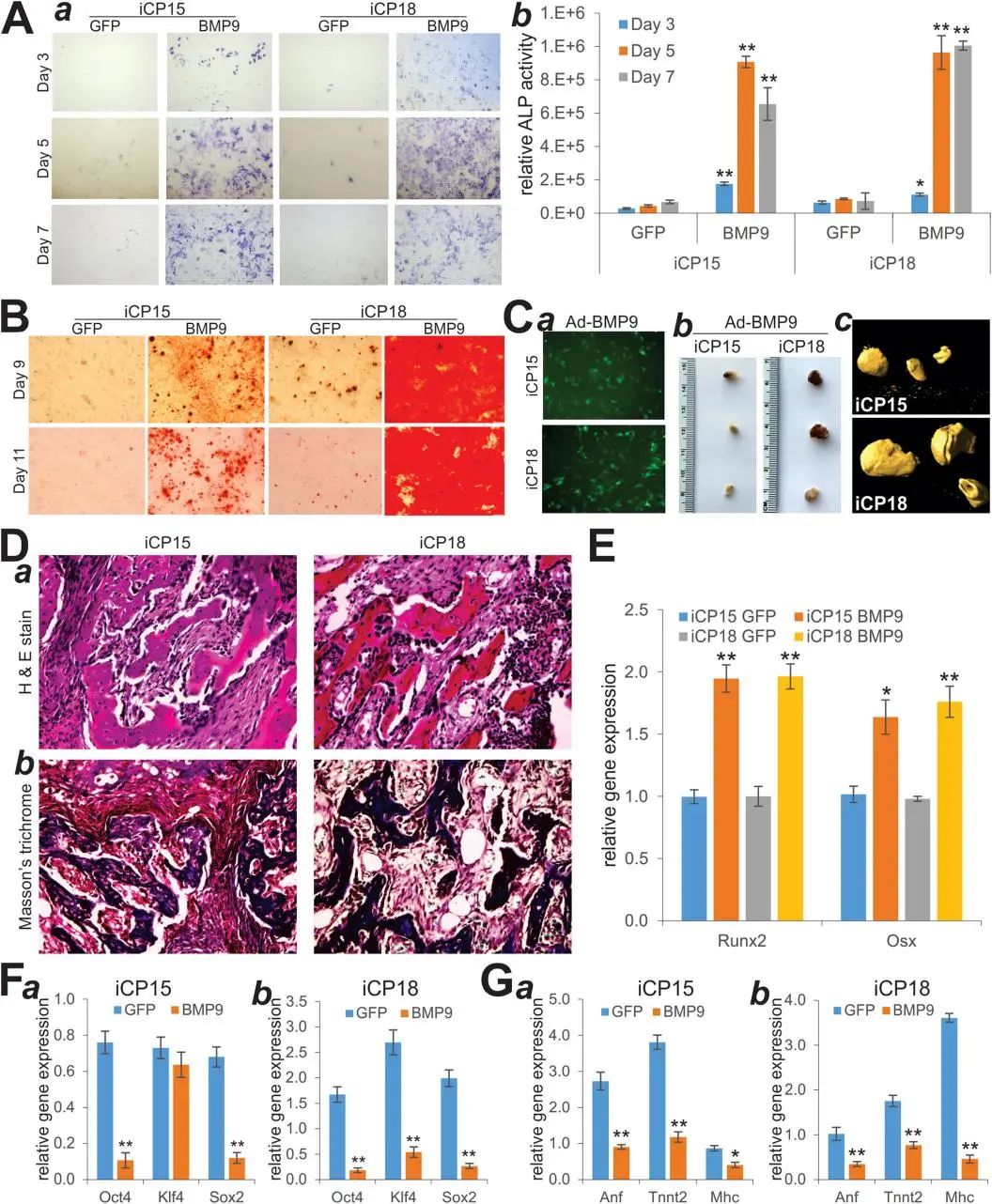
图1. SV40大T抗原使小鼠心肌祖细胞具有MSC特性和成骨能力。
3. 研究结论
本研究表明,CRE重组酶可逆转SV40 LTA诱导的小鼠E15.5胎儿心脏CPs永生化,通过SV40 LTA诱导的细胞永生化,小鼠心肌祖细胞具有间充质干细胞特性。在BMP9刺激下,iCPs细胞在体外和体内都能进行成骨分化,进一步揭示了BMP9驱动成骨细胞特异性分化的具体机制。这一发现为心肌细胞再生和治疗提供了新的思路,并且对细胞永生化的机制有着重要的启示作用。
文章来源
免费全文下载链接:
https://www.sciencedirect.com/science/article/pii/S235230422200277X
引用这篇文章:
Yu Y, Zhong J, Chen C, et al. SV40 large T antigen-induced immortalization reprograms mouse cardiomyocyte progenitors with mesenchymal stem cell characteristics and osteogenic potential. Genes Dis. 2023;10(4):1161-1164.