亮点:
1. AP患者的胆汁酸代谢物谱与健康对照组不同。
2. CDCA在急性胰腺炎的急性期降低,在恢复期升高。
3. CDCA与AP患者的胰腺坏死密切相关。
4. CDCA及其受体FXR可能是治疗胰腺腺泡细胞坏死的新靶点。
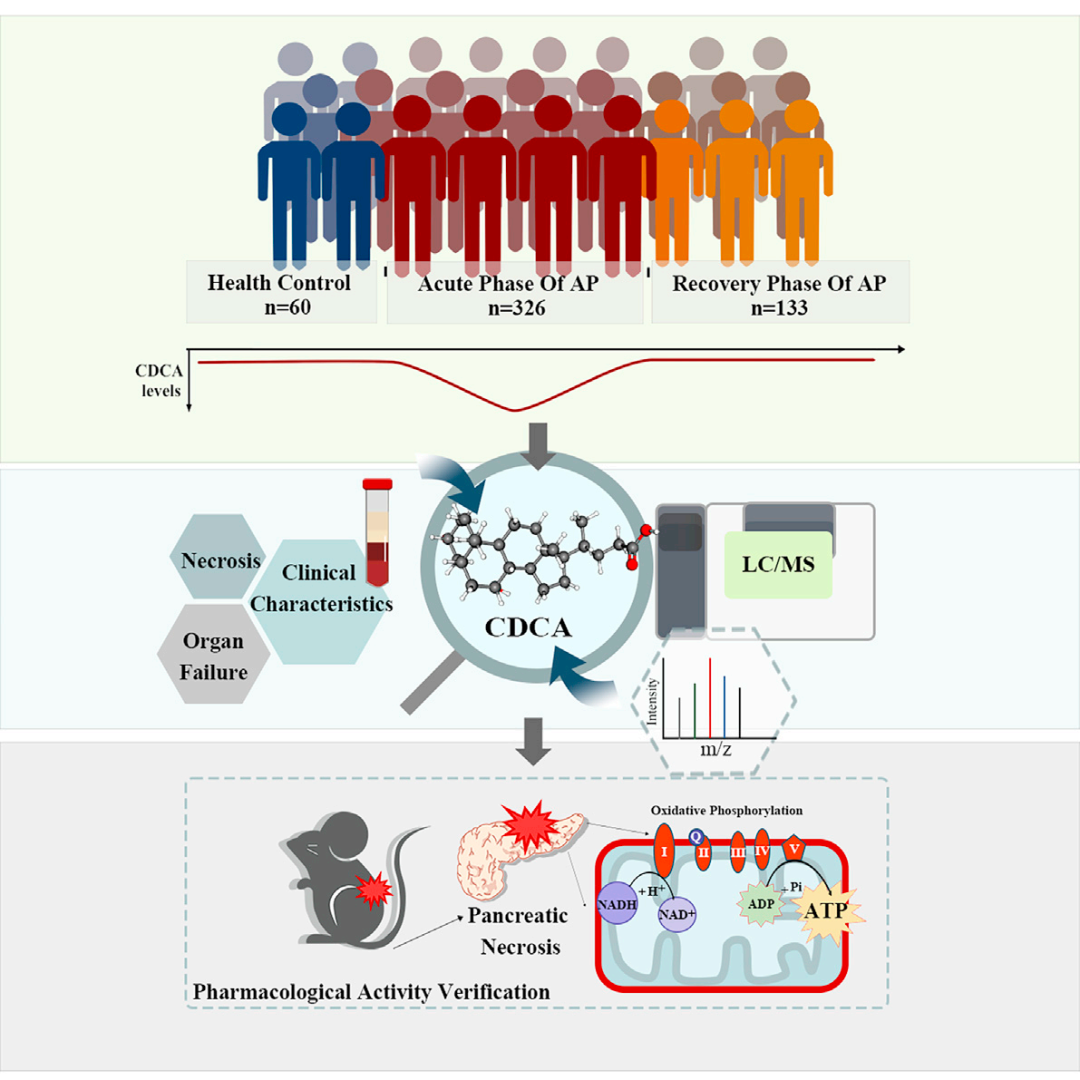
1. AP急性期患者血清胆汁酸代谢成分的变化
本研究共纳入326例AP发病时间小于7天的患者和60例健康对照组,研究设计流程图如图1所示。根据亚特兰大分类诊断标准,我们将患者分为轻度急性胰腺炎(MAP,n = 99)、中度急性胰腺炎(MSAP,n = 144)和重度急性胰腺炎(SAP,n = 83)。临床数据包括健康对照组和AP患者的临床信息和人口统计学数据。
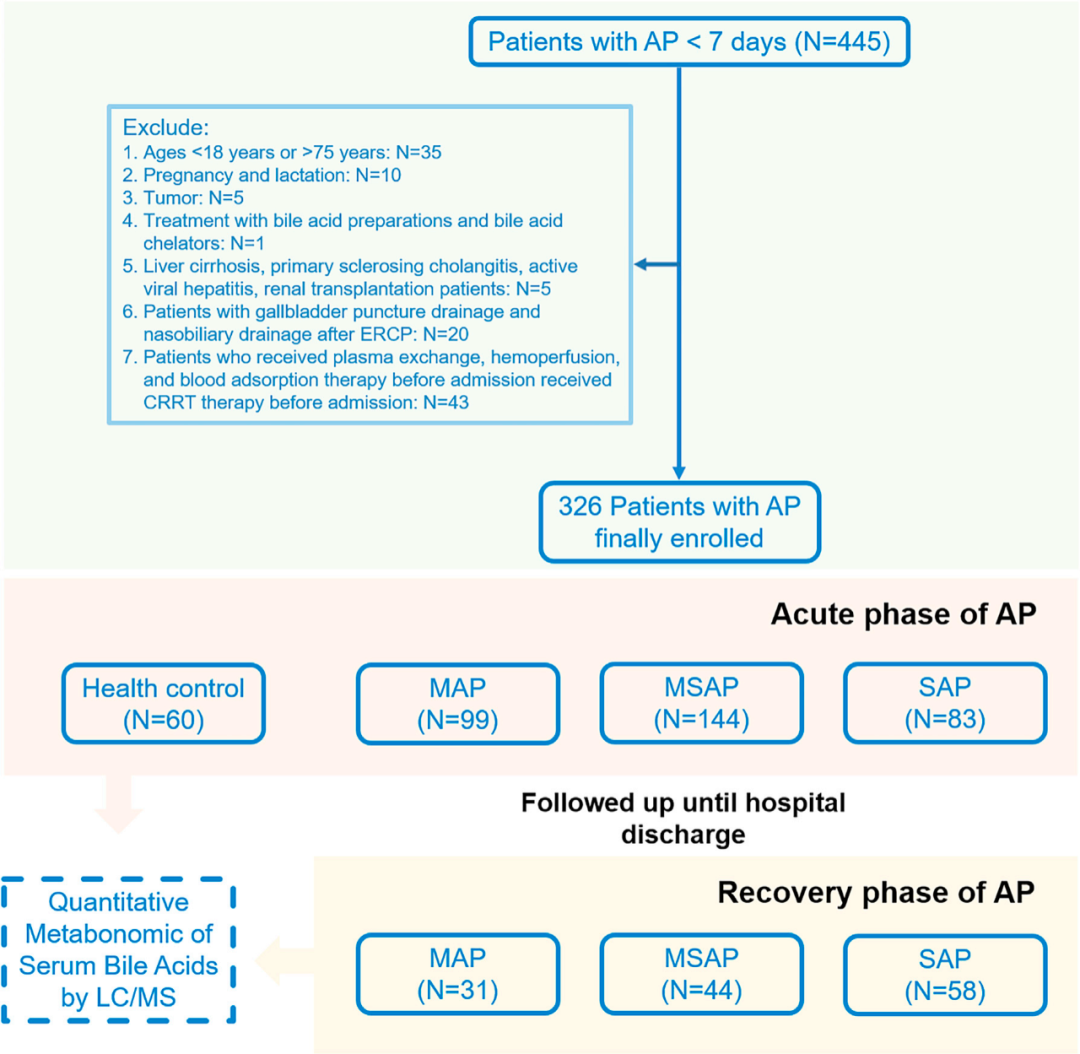
图1 该队列的研究设计流程图
为了研究AP患者胆汁酸代谢物的改变情况,我们对纳入人群的血清进行了胆汁酸靶向代谢组学质谱分析,检测发现有39种与胆汁酸代谢相关的代谢物。主成分分析(PCA)显示,急性期AP患者与健康对照组之间的胆汁酸代谢物聚类分析存在显著差异(图2A)。胆汁酸代谢物中共有17种代谢物符合质量控制标准,通过火山图的定量分析,本研究展示了血清胆汁酸代谢物水平的变化(图2B)。我们根据AP患者的严重程度进行亚组分析,热图中显示了17种胆汁酸代谢物的平均归一化浓度(图2C),使用克利夫兰点图展示了不同胆汁酸代谢物水平的倍数变化(图2D)。总体而言,差异代谢物主要是初级胆汁酸(CDCA和胆酸(CA))及其下游代谢物或结合形式的胆汁酸。图2E直观地显示出AP的严重程度与初级胆汁酸(CDCA和CA)、其下游代谢衍生的次级胆汁酸或偶联修饰形式的胆汁酸的浓度水平变化具有显著相关性。另外,我们根据急性期AP的发病时间将患者分为三组,结果显示CDCA或CA在AP早期发病时(48h内)有明显的下降趋势;此外,来自CDCA或CA的次级胆汁酸或偶联修饰形式的胆汁酸也表现出相同的变化趋势。最后,进行的亚组分析发现上述变化与AP的病因无关。此外,为了保证结果的可靠性和普遍性,我们通过扬州大学附属医院的数据,包括38名健康对照受试者,125名MAP,35名MASP(中度重症急性胰腺炎)和18名SAP进行验证。与南京队列的结果一致,AP患者的CDCA和CA也显著降低,并且胆汁酸减少的程度与疾病的严重程度相关。
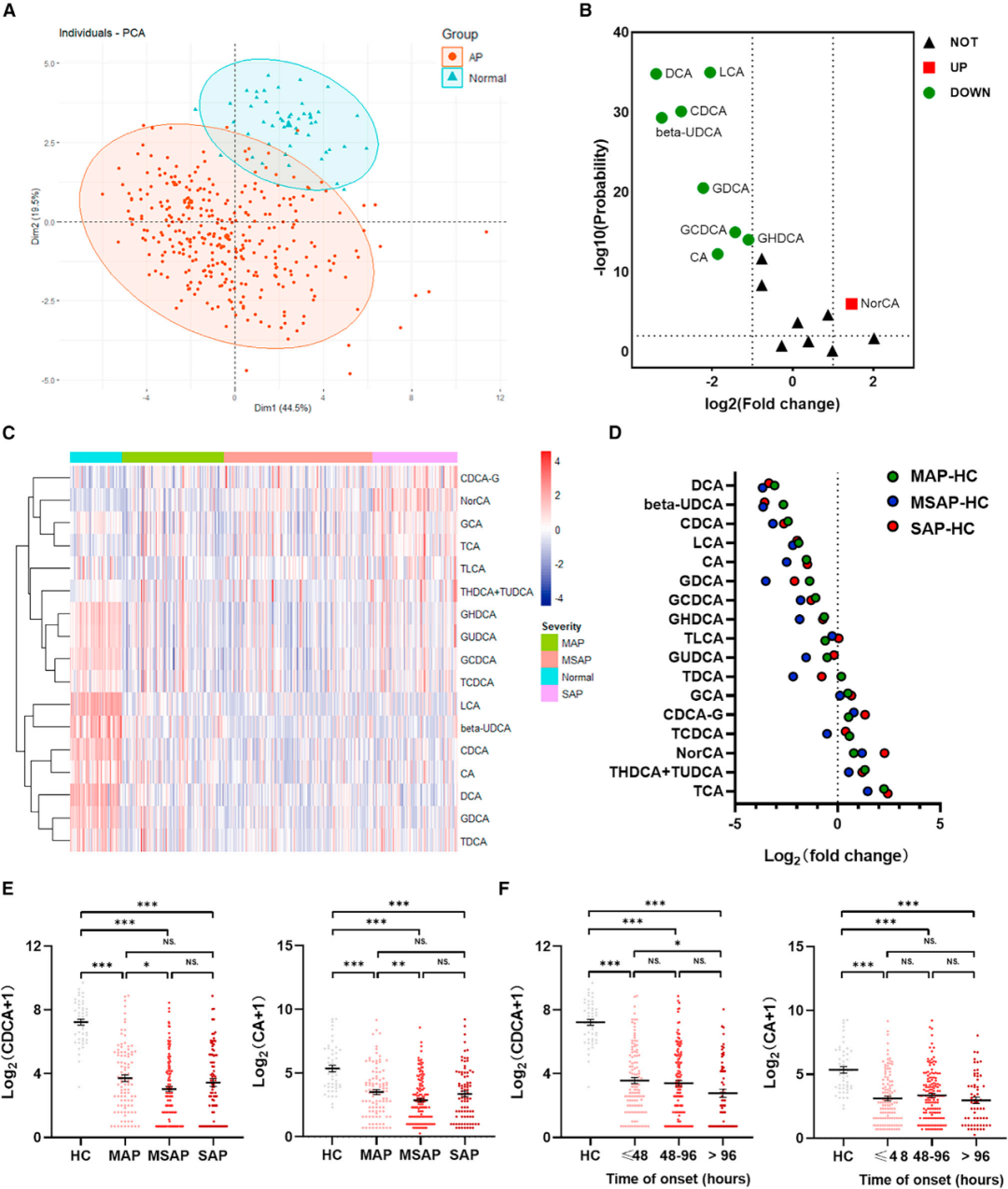
图2 AP急性期患者血清胆汁酸代谢成分的变化。(A)胆汁酸靶向代谢组学的主成分分析(PCA)。(B)火山图显示,与健康对照组(HCs,n = 60)相比,在AP患者(n = 326)的急性期,有17种胆汁酸的水平显著上调或下调。血清胆汁酸成分表现为红色(显著增加)或绿色(显著减少)。(C)热图展示了AP患者(n = 326)和健康对照组(HCs,n = 60)急性期通过胆汁酸靶向代谢组学分析的胆汁酸代谢物浓度,胆汁酸代谢物浓度使用平均归一化数值表示。(D)克利夫兰点图显示血清胆汁酸水平的倍数变化(log2转换)的排序。绿、蓝和红点分别代表MAP(n = 99)、MASP(n = 144)和SAP(n = 83)患者相对于HC(n = 60)的倍数变化。(E)散点图显示了MAP(n = 99)、MASP(n = 144)、SAP(n = 83)和健康对照组(n = 60)患者的血清CDCA和CA归一化浓度(log2转换)。(F)散点图显示AP急性期患者(根据发病和入院之间的不同时间间隔分组)(<48 h, n = 118; 48–96 h, n = 146; >96 n = 62)和健康对照组(HCs,n = 60)血清CDCA和CA归一化浓度的log2转换变化。数字表示平均值和平均值的标准误差(SEM)。***p < 0.001,**p < 0.01,和*p < 0.05。NS,无统计学意义。
2. AP恢复期患者血清胆汁酸代谢成分的变化为评估血清胆汁酸代谢物水平的变化与AP的病程之间的相关性,本研究收集了MAP(n = 31)、MSAP(n = 44)和SAP(n = 58)患者的康复期血清样本,共133例AP患者,并进行了靶向代谢组学质谱分析。从火山图、热图和克利夫兰图中可以看出,AP患者与健康对照组在康复期的多种代谢物存在明显差异。与急性期相比,康复期只有初级胆汁酸CDCA和CA显著升高,这一发现与PCA结果一致(两组的聚类分析无显著差异)(图3A-3D)。此外,康复期的MSAP和SAP患者的CDCA和CA代谢物水平的变化也具有统计学差异(p < 0.05)(图3E)。
结合两种不同人群的胆汁酸代谢组学定量结果,我们发现CDCA和CA水平有显著变化,在急性期显著下降,在AP康复期显著升高;此外,CDCA和CA水平的下降与AP的严重程度显著相关。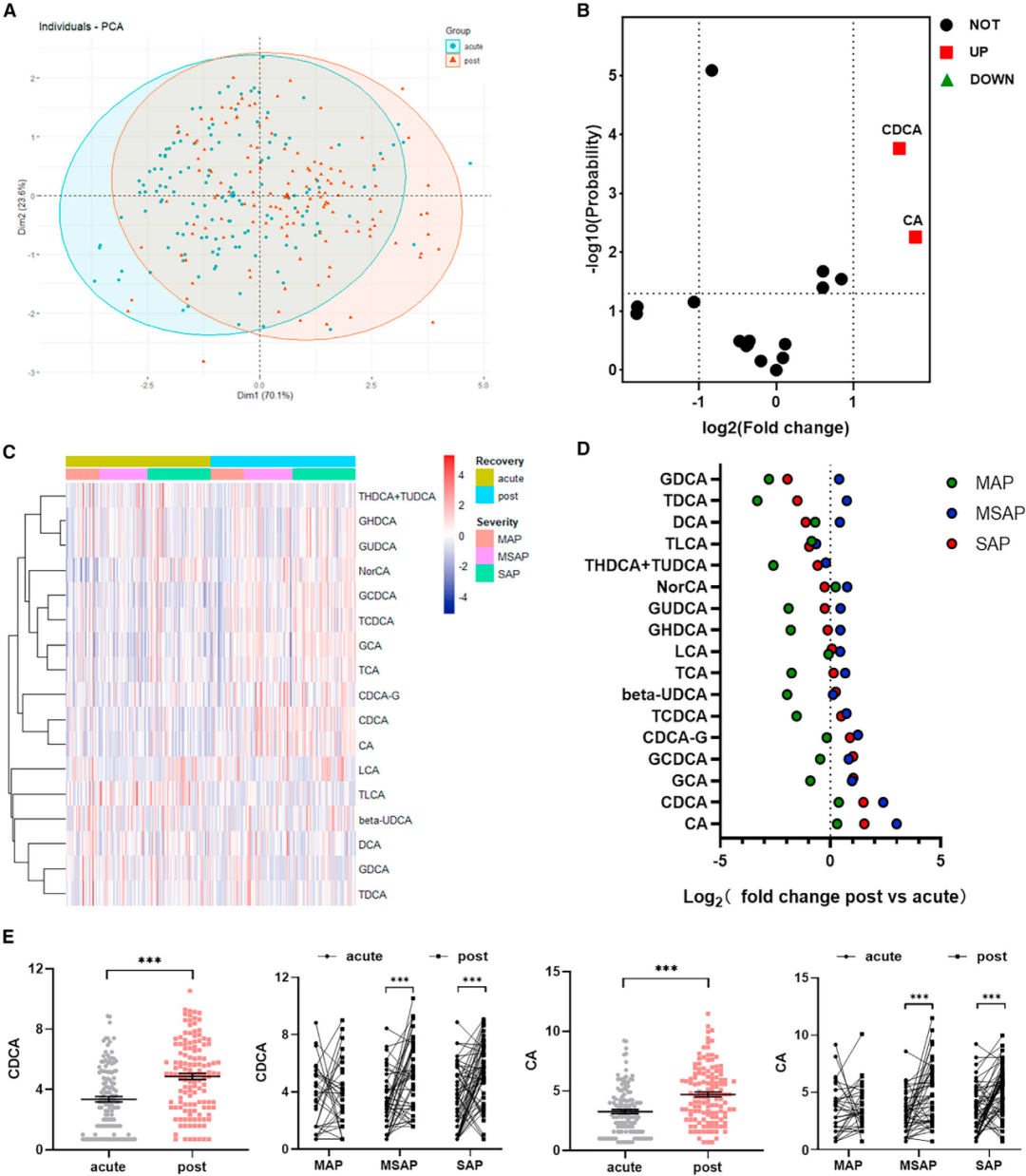
为了评估CDCA和CA的潜在转化价值,本研究评估了血清中CDCA或CA水平与AP的临床特征之间的关联。胰腺坏死和器官功能衰竭的同时发生是导致AP患者预后不良的主要原因。结果显示,急性坏死性积聚组(ANC)的血清CDCA或CA水平明显低于非ANC组;但在胰腺感染坏死和器官衰竭患者中未观察到这种差异(图4A和4B)。单因素逻辑回归分析显示,归一化CDCA和CA水平下降是AP患者胰腺坏死的危险因素。此外,在对年龄、性别、BMI、病因和致病参数进行校正后,多变量逻辑回归分析显示,归一化CDCA和CA水平的降低是AP患者胰腺坏死的独立危险因素(图4C)。

4. 除了CA以外,CDCA及其衍生物奥贝胆酸(OCA)在体内外的腺泡细胞损伤和胰腺坏死中均显示出药理保护作用
在纳入的临床队列中发现原发性胆汁酸(CDCA和CA)与胰腺坏死密切相关,但没有CDCA或CA对腺泡细胞坏死的生物学效应的报道。在这里,我们使用雨蛙素建立了一个经典的AP小鼠模型,用于观察小鼠血清胆汁酸水平的变化。利用靶向质谱法,我们发现AP小鼠的循环CDCA和CA水平显著降低,这与人群中的趋势是一致的(图5A)。胆汁酸合成的经典途径是由CYP7A1酶介导的,而替代途径是由CYP27A1酶介导的。这是人类中最丰富的两种胆汁酸合成酶,它们之间的比例是由固醇Cyp8B1决定的。与正常对照组小鼠相比,AP小鼠中CYP7A1和CYP27A1的mRNA水平显著降低。这表明AP期间CDCA和CA水平的降低可能与合成水平的降低有关。Cyp7B1和Cyp8B1的mRNA水平无显著差异,说明胆汁酸合成的代谢途径没有明显改变(图5B)。
随后,我们在体外评估了CDCA和CA腺泡细胞坏死的药理作用,利用胆囊收缩素八肽(CCK)和牛磺石胆酸3-硫酸盐二钠盐(TLCS)诱导的两种原发性腺泡细胞损伤模型,研究发现CDCA显著降低了乳酸脱氢酶(LDH)的释放,并减少了由磷脂酰肌醇染色标记的坏死腺泡细胞的数量(图5C-5E),而CA没有显示类似的效果。
OCA是CDCA的衍生物,具有良好的生物安全性,其与下游受体的结合能力明显高于CDCA,它已经是FDA批准的用于治疗原发性胆汁性肝硬化的上市药物。考虑到该药物未来临床转化的潜力,我们也用OCA进行了类似的体外细胞实验。与预期的一样,OCA显著减少了两种原发性腺泡细胞损伤模型中的细胞坏死(图5C-5E)。
基于以上细胞实验结果,我们只使用CDCA和OCA进行了后续的动物实验。在腹腔注射不同浓度梯度的OCA或CDCA来预防雨蛙素诱导的AP后,发现在体内发挥药理作用的最佳保护剂量是20mg/kg OCA和40 mg/kg CDCA。此外,我们在另一个TLCS诱导的AP模型实验中观察到,CDCA或OCA治疗可显著改善AP小鼠的胰腺组织病理学损伤。为了模拟实际的临床给药途径,我们采用了CDCA或OCA的小鼠灌胃实验,并得到了相似的治疗效果。最后,我们发现CDCA和OCA的药理保护活性与小鼠性别无关。
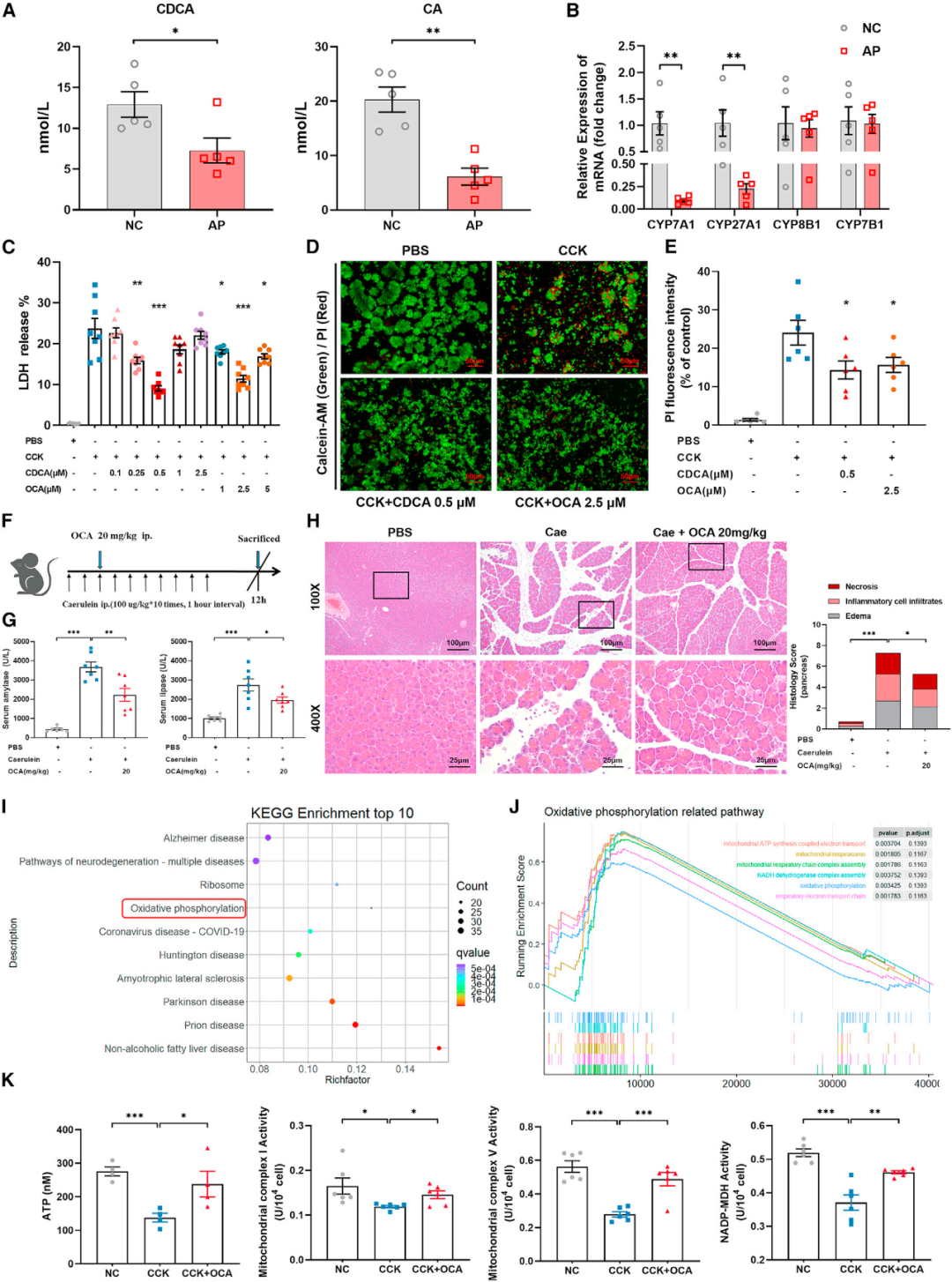
5. OCA调节线粒体氧化磷酸化途径,促进细胞ATP的产生
在AP模型小鼠中,OCA对AP小鼠模型的药理保护活性明显优于CDCA。因此,我们采用OCA进行后续的机制研究,通过从CCK诱导的损伤的胰腺腺泡细胞中提取mRNA,进行RNA测序。京都基因和基因组百科全书(KEGG)的基因富集分析发现,显著改变的前十种途径中存在氧化磷酸化通路(图5I)。同样,基因集富集分析(GSEA)显示了“线粒体ATP合成耦合电子传递”、“线粒体呼吸链复合物组装”、“NADH脱氢酶复合物组装”和“氧化磷酸化”的明显改变(图5J)。基于这些结果,我们检测了OCA干预前后损伤的腺泡细胞的ATP产生、线粒体呼吸链复合物I和V活性以及NADP-苹果酸脱氢酶活性。结果验证了RNA测序结果,即OCA显著增加了腺泡细胞中ATP的产生,增强了线粒体功能,改善了线粒体氧化磷酸化(图5K)。在体外实验中,线粒体ROS(MitROS)和线粒体膜电位JC-1染色同样证实了CDCA及其衍生物OCA改善了原代腺泡细胞线粒体功能。综上所述,以上结果证实了体内外补充OCA可调节线粒体氧化磷酸化的代谢途径,减少炎症反应,减轻腺泡细胞坏死的,达到缓解AP的作用。
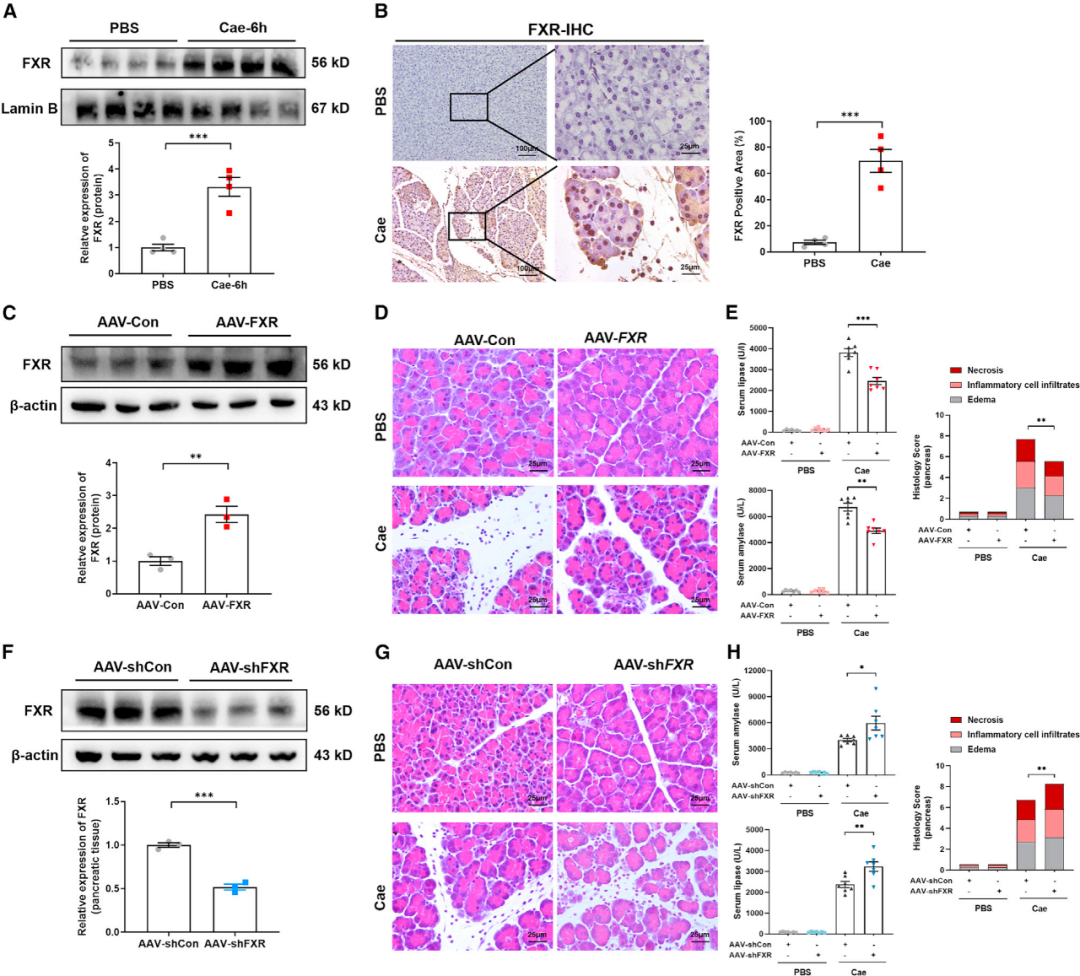
6. 胆汁酸受体FXR调节AP小鼠的胰腺坏死
CDCA和OCA可以通过其依赖的受体调节信号分子,其中FXR是亲和力最高的受体。既往研究证实,FXR主要在肝脏和胃肠道表达,CDCA和FXR均有炎症调节作用。然而,FXR在AP和损伤的腺泡细胞中的作用尚未见报道。为了证实AP期间胰腺组织中FXR是否发生显著变化,我们首先检测了FXR在AP腺泡细胞中的表达水平。免疫组化和免疫印迹(WB)结果显示,雨蛙素处理6h后,胰腺腺泡细胞中FXR的表达升高,这与核受体的表达相关(图6A和6B)。此外,通过原位注射腺相关病毒-法尼醇X受体(AAV-FXR)过表达载体进入胰腺,产生胰腺特异性FXR过表达小鼠。使用WB检测胰腺组织,发现FXR蛋白表达水平明显提高,表明 AAV 转染成功。在雨蛙素诱导的小鼠AP模型中,我们发现胰腺特异性过表达FXR显著改善了AP小鼠的胰腺组织病理学损伤,并降低了胰腺腺泡细胞死亡的程度和血清淀粉酶和脂肪酶水平(图6C-6E)。同样,使用原位注射AAV-FXR干扰载体构建胰腺特异性FXR敲低小鼠,我们发现FXR受到抑制的小鼠中,经过雨蛙素诱导后胰腺损伤明显加重(图6F-6H)。以上结果表明,调节CDCA受体FXR可减轻小鼠AP模型中的腺泡细胞坏死,并防止AP的加重。
讨论
到目前为止,本研究是最广泛和最详细的胆汁酸代谢组学研究。该研究提出了一种新的观点,AP中的胆汁酸代谢会发生显著改变,CDCA及其受体FXR可能是AP潜在的治疗靶点。该研究提出了几个重要的发现:首先,与健康对照组相比,AP患者的多种胆汁酸代谢发生了显著变化。第二,CDCA在急性期显著降低,在AP恢复期显著增加,并与AP患者的胰腺坏死密切相关。第三,补充CDCA及其衍生物OCA并调节其受体FXR可有效诱导AP小鼠腺泡细胞坏死。综上所述,靶向调控CDCA可能是治疗AP患者腺泡细胞坏死的一种新策略。
最近在阿尔茨海默症、神经退行性疾病和多发性硬化症、中枢神经系统炎症性脱髓鞘疾病的患者中,研究者发现低水平的循环胆汁酸代谢物与认知障碍的发展密切相关,并可影响星形胶质细胞的神经毒性和小胶质细胞的促炎极化。此外,在一组代谢障碍患者中,肥胖和糖尿病都与血清胆酸(HCA)浓度较低相关,而血清HCA水平是5年和10年内发生代谢紊乱的强有力预测因子。在本研究中,我们采用串联质谱定量AP患者血清中胆汁酸代谢相关代谢产物,共17种胆汁酸,主要是两种初级胆汁酸(CDCA和CA)及其下游代谢产物或结合产物,符合质量控制标准,并纳入定量分析,这一发现与以往结肠癌患者队列中胆汁酸水平变化的前瞻性研究一致。结合AP小鼠模型中肝脏胆汁酸合成关键酶mRNA水平的变化情况:CYP7A1和CYP27A1的mRNA水平明显变化,而CYP8B1和CYP7B1的mRNA水平无明显变化,我们认为CA和CDCA的减少主要是由于肝脏合成的减少,这可能与AP相关的全身炎症反应介导的肝损伤有关。此外,我们进一步分析不同类型的胆汁酸水平的变化发现CDCA和CA显著增加了下游次级胆汁酸的转化。综上所述,胆汁酸代谢合成的降低和CDCA代谢转化的增加共同导致了AP患者循环中原代胆汁酸CDCA和CA的降低。
胆汁酸对胰腺细胞的影响存在差异,这可能与不同胆汁酸的极性有关。Quang等人的研究表明,不同类型的胆汁酸在不同的AP动物模型中表现出不同的作用。例如,在雨蛙素、L-精氨酸、胰管结扎或胆管和胰管联合结扎诱导的AP小鼠模型中,以TLCS为代表的亲水性胆汁酸可显著增强胰腺腺泡细胞胰蛋白酶活性,另一方面,以TUDCA和LCA为代表的疏水胆汁酸在雨蛙素和L-精氨酸诱导的AP小鼠模型中具有显著的保护作用,而在胰管结扎或胆管和胰管联合结扎诱导的AP小鼠模型中没有保护作用。在本研究中,我们观察到CDCA对腺泡细胞坏死有明显的抑制作用,而CA没有作用。这可能是由于这两种胆汁酸的亲水性和疏水性所致。CA是一种亲水胆汁酸,疏水参数为3.6,而CDCA则具有疏水性。
线粒体通过氧化磷酸化产生ATP,为细胞的正常生理活动提供能量。由于线粒体膜通透性转换孔的打开和线粒体膜功能的破坏,导致线粒体膜电位下降,线粒体含量降低、线粒体功能障碍和ATP的消耗,这些都是腺泡细胞早期死亡的关键事件。Chen等人发现,糖尿病小鼠脱氧鞘脂的增加可抑制腺泡细胞氧化磷酸化途径,减少ATP的产生,并加重腺泡细胞坏死。早期腺泡细胞死亡导致的胰腺坏死是AP患者预后不良的主要原因。腺泡细胞坏死会对胰腺造成不可逆的损伤和一系列炎症反应,同时导致器官衰竭、全身炎症反应综合征,以及AP患者的死亡率显著升高。有研究报道,CDCA治疗可增加细胞内ATP水平,从而通过调节细胞周期和线粒体功能促进肠上皮细胞增殖。在本研究中,经转录组学、酶活性分析、线粒体ROS和线粒体膜电位JC-1染色证实,服用OCA后,腺泡细胞中氧化磷酸化、ATP生成和线粒体功能相关的线粒体呼吸链复合物I和V基因明显上调,从而显著改善了腺泡细胞的坏死情况。
研究表明,人类FXR位点的突变似乎不会改变胰腺炎的易感性,并且FXR-KO小鼠经过雨蛙素诱导后,FXR功能的缺失并不影响AP的严重程度。在本研究中,我们进行了外源性AAV胰腺原位注射,以特异性调节腺泡细胞中FXR的表达,发现在AP小鼠模型中,调节CDCA受体FXR可减轻腺泡细胞坏死,并防止AP的加重。我们研究的结论表明,在整体内源性FXR缺失的AP小鼠模型中,FXR可能在其他细胞和器官中发挥调节作用,这一现象有待进一步研究。
综上所述,本研究首次应用靶向代谢组学质谱分析了326例AP患者的血清胆汁酸代谢动态变化。在体内和体外,补充CDCA或其衍生物OCA并调节其受体FXR,可减轻腺泡细胞坏死并防止AP的加重。靶向调控CDCA可能是治疗AP患者腺泡细胞坏死的一种新策略,但仍需进一步验证。研究的局限性
然而,本研究仍存在一定的局限性。首先,虽然CDCA是变化最明显的胆汁酸之一,但仍需考虑其他胆汁酸种类,如NorCA,其对腺泡细胞的影响还需在其他研究中进一步探讨。其次,虽然本研究是国际上首次关于临床AP患者血清胆汁酸靶向代谢组学质谱的报道,但样本量较小,本研究仅纳入单中心AP患者。该队列中患者的来源为AP的三级转诊中心,导致MSAP和SAP比值相对较高。为了解决这个问题,我们从另一家医院的AP患者中收集了额外的血清样本,以验证CDCA和CA变化的一致性,并尽量减少严重程度分布偏倚的潜在影响。然而,这仍然需要来自不同国家和地区的临床队列的验证。由于东西方民族的差异,AP病因的分布表现出不同的特征。本研究可能存在一些研究偏倚,临床队列不能代表一般AP人群。此外,我们没有在发病初期从同一患者身上连续采集血液样本,导致缺乏胆汁酸代谢变化的动态表现。因此,本研究的结果需要在大样本多中心队列研究中进行重复验证。
原文链接: https://pubmed.ncbi.nlm.nih.gov/38035885/