细胞外囊泡(EVs)是一类天然脂质纳米颗粒,可由广泛类型的细胞分泌而来。在恶性肿瘤中,来源于癌细胞的EVs通过促进肿瘤生长和侵袭、干扰抗癌免疫以及在远处器官中建立转移前生态位来促进癌症的进展和转移。近年来,针对癌症衍生的EV提出了多种策略来改善癌症患者的预后,包括抑制EV生成、在转运过程中干扰EV以及阻断受体细胞对EV的吸收。EV工程化技术策略的发展也显示出利用癌症衍生的EV作为抗癌剂的潜力。
就在年初,哥伦比亚大学程柯教授等人在Nat. Nanotech.上发表文章,提出利用吸入途径将IL-12 mRNA装载到细胞外囊泡中,以实现更为精准的肿瘤微环境传递。不到一个月的时间,该团队就再次发表关于细胞外囊泡的顶刊综述。在本综述中,哥伦比亚大学程柯教授等人总结了目前对癌症衍生EVs起源和功能的理解,并回顾了针对这些EVs的抗癌治疗的最新进展。相关工作以“Anticancer Therapy Targeting Cancer-Derived Extracellular Vesicles”为题发表在ACS Nano。

【文章要点】
这篇综述提供了对EV生物发生及其在癌症进展不同阶段的不同功能的全面概述(图1)。为了破坏癌症衍生EVs的促肿瘤作用,大量研究已经提出了多种策略来抑制它们在起源处的生物发生、在循环过程中选择性地消除它们或者减少受体细胞对它们的吸收。作者在此还回顾了最近在将癌症衍生的EVs工程化为药物递送载体或抗癌疫苗方面的进展,并对该领域进行了展望(图2)。
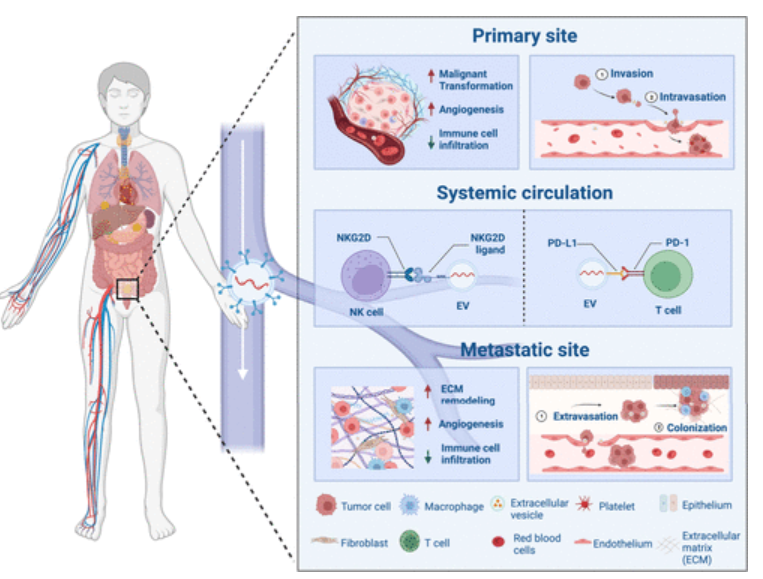
图1 EV在癌症发展与转移过程中扮演的角色
同时,作者也指出,目前对癌症衍生EVs生物发生的了解主要基于体外观察。由于缺乏追踪活体动物中EV分泌的强大平台,调节癌症EV分泌的关键信号通路是否在体内也有效,这在很大程度上仍然未知。此外,由于EV的生物发生和分泌在很大程度上取决于癌症的类型和阶段,因此迫切需要在能够在3D环境中或直接在体内模拟癌症微环境的平台中进行高含量筛选,以识别癌症特异性EV分泌抑制剂。事实上,同一肿瘤内的癌症细胞也存在异质性,需要更深入的研究来发现同一位点的不同亚型癌症细胞在EV分泌和货物选择方面是否具有不同的能力。在选择性消除癌症衍生EV方面,识别癌症特异性EV表面标记物作为靶标至关重要,因此还需要开发分离高纯度EV的技术以促进这些靶标的发现。癌症衍生的EVs采用配体-受体配对(如整合素)来促进不同器官的生长。然而,由于整合素的配体广泛存在于ECM中,它们可以在被细胞吸收并破坏其功能之前与循环EV结合。这就是为什么在心脏和肌肉等通常不会发生转移的器官中也可以看到EV积聚的原因。因此,需要进一步的研究来确定在不同器官中调节细胞摄取的特定配体,以便开发阻断癌症衍生的EV吸附的策略。
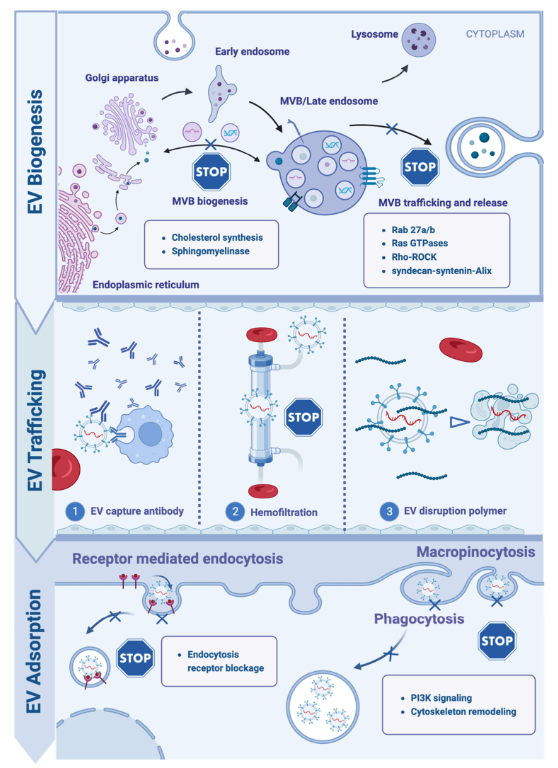
图2 针对癌症衍生EVs的策略:抑制分泌,破坏循环,减少受体细胞的吸附
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c06462