大量研究显示,在粘膜免疫的PD-1/PD-L1通路中,肠组织中表达的PD-L1是先天免疫细胞预防肠道炎症的重要配体。重组Fc-融合的 PD-L1就可以通过与PD-1和B7-1的相互作用抑制免疫细胞及其细胞因子的产生,从而在IBD治疗中实现抗炎作用。然而,由于免疫抑制的存在,全身PD-L1给药可能会导致不可预测的不良反应。
在本研究中,陆军军医大学陈磊教授和Dinglin Zhang等人发现活性氧(ROS)响应性纳米颗粒在小鼠结肠炎模型中可增强PD-L1的疗效和安全性。纳米颗粒可控制与Fc融合的PD-L1(PD-L1-Fc)在结肠炎症部位的积聚和释放。与全身给予PD-L1-Fc相比,纳米疗法在减轻炎症症状方面显示出优越性,并减轻了给予PD-L1-Vc的不良影响。纳米颗粒配制的PD-L1-Fc可影响促炎和抗炎细胞因子的产生,减弱巨噬细胞、中性粒细胞和树突状细胞的浸润,增加Treg、Th1和Tfh细胞的频率,重塑肠道微生物群组成;并增加短链脂肪酸的产生。总之,PD-L1-Fc修饰的纳米颗粒可以为IBD的靶向治疗提供有效和安全的策略。相关工作以“Targeted delivery of Fc-fused PD-L1 for effective management of acute and chronic colitis”为题发表在Nature Communications。

【文章要点】
一、PD-L1-Fc/Oxi-αCD纳米颗粒
在先前的工作中,作者所在团队合成了了4-苯基硼酸频哪醇酯偶联环糊精生物材料(Oxi-αCD),这是一种活性氧(ROS)响应性纳米材料,具有良好的生物相容性和生物安全性,可作为靶向治疗黑色素瘤和类风湿性关节炎的药物载体(Adv. Healthcare Mater 4, 69–76 (2015);Biomaterials 232, 119730 (2020))。鉴于ROS过量产生与IBD的发病机制密切相关,ROS响应性纳米材料也可用于肠道炎症部位的药物递送。也就是说,ROS响应性纳米颗粒有望通过血管系统到达结肠发炎部位,并在随后被高浓度ROS水解,导致其具有免疫调节功能的货物局部释放。因此,在本项研究中,作者首先使用纳米沉淀/自组装方法制备了Oxi-αCD纳米颗粒(空白/Oxi-αCD纳米颗粒)。空白/Oxi-αCD纳米颗粒的外围涂有卵磷脂和DSPE-PEG2000-NHS,这有助于稳定纳米颗粒并延长其在血液中的循环时间。更重要的是,DSPE-PEG2000-NHS可以与PD-L1-Fc蛋白形成酰胺键,以制备PD-L1-Fc-修饰的纳米颗粒(PD-L1-Fc/Oxi-αCD纳米颗粒)。(图1)。
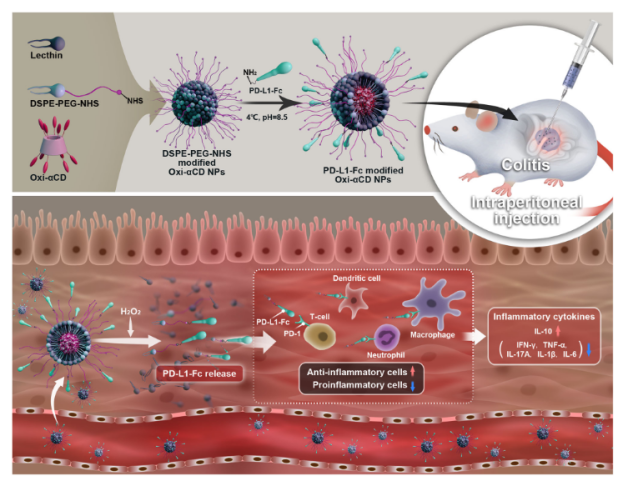
图1 材料制备及靶向治疗结肠炎示意图
二、治疗急性/慢性结肠炎
经过腹膜内注射后,研究发现PD-L1-Fc/Oxi-αCD纳米颗粒在DSS诱导的结肠炎小鼠的炎症结肠中有显著的定位和长期积累。此外, PD-L1-Fc/Oxi-αCD纳米粒子可明显结合结肠炎小鼠结肠固有层中的CD4+T淋巴细胞、巨噬细胞、中性粒细胞和DC。与游离的PD-L1-Fc相比,PD-L1-Fc/Oxi-αCD纳米粒子对急性或慢性结肠炎有更好的疗效。这可能主要是因为PD-L1-Fc/Oxi-αCD纳米粒子可以在炎症组织中积累,并对炎症细胞表现出特殊的亲和力。此外,PD-L1-Fc处理或PD-L1-Fc/Oxi-αCD纳米颗粒处理可逆转DSS诱导小鼠中Treg和Tfh细胞频率的降低,并且PD-L1-Fc/Oxi-βCD纳米颗粒引起频率的增加更为显著。最后,PD-L1-Fc/Oxi-αCD纳米粒子处理也可使患病肠道的微生物群落状态从失调状态转变为正常状态。与PD-L1-Fc治疗相比,PD-L1-Fc/Oxi-αCD纳米粒子治疗对主要器官没有损伤,意味着负载PD-L1-Fc的Oxi-αCD纳米颗粒比PD-L1-Fc具有更少的副作用和更好的安全性(图2)。
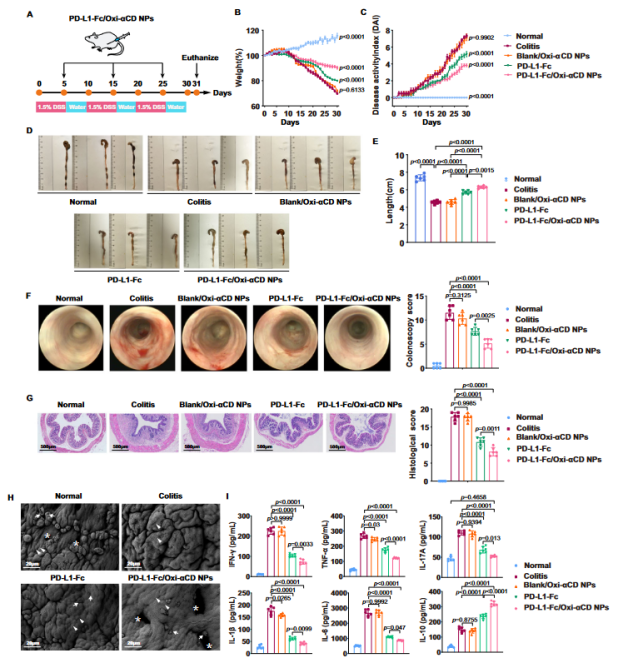
图2 PD-L1-Fc/Oxi-αCD治疗结肠炎效果
原文链接:
https://www.nature.com/articles/s41467-024-46025-0#ref-CR20