先天性心脏病(Congenital heart disease, CHD)是指在胚胎发育时期心脏及大血管的发育异常而导致婴儿出生时的心脏结构缺陷。先天性心脏病是最常见的出生缺陷,大约1%的新生儿会患此病。目前~55%先心病的形成原因仍不清楚。Pediatric Cardiac Genomics Consortium (PCGC)通过对病因不明的先心病家系进行全外显子组(WES)测序分析,发现与先心病相关的新生点突变(de novo variants, DNVs)主要富集在心脏里高表达的基因上,其中很多基因与染色质修饰相关。然而,编码区DNVs只能解释~10%的病例。要知道,大约99%的人类基因组属于非编码区。鉴于以上原因,科学家们推测非编码区的点突变也会导致先心病的发生,这将为那些病因不明的病例提供新的解释。PCGC通过对749个先心病的家系进行全基因组测序(WGS)分析,鉴定出了~58000非编码区新生点突变(Noncoding de novo variants, ncDNVs)。非编码区点突变数量多且保守性极低,很难利用动物模型来研究,大多数研究只停留在相关性分析层面,如何在功能上解析非编码区点突变是一个极具挑战的难题。
2024年2月20日,美国哈佛大学医学院William Pu研究组和Christine Seidman研究组合作在Nature Genetics上发表了题为“Functional disp of human cardiac enhancers and noncoding de novo variants in congenital heart disease”的研究论文,此论文全面解析了人类心肌细胞中增强子的活性和先天性心脏病中的非编码区点突变。

编码区的点突变可以用错义突变、无义突变、移码突变、RNA剪切位点突变等来评价它们的影响。但是,这些原则不适用于非编码区点突变。为了更好地评价非编码点突变的影响,该团队提出使用增强子活性和报告基因系统来评价非编码区点突变。如果一个非编码区点突变显著影响了增强子活性,那么就可以把这个点突变定义为一个破坏性的点突变。为了一次性评价成千上万个人类心肌细胞增强子活性,研究团队提出使用慢病毒介导的高通量平行报告基因系统(lentiviral massively parallel reporter assay, lentiMPRA)和人iPS细胞分化的心肌细胞(hiPSC-derived cardiomyocytes, hiPSC-CMs)模型来进行探究(Fig 1)。首先,该团队利用hiPSC-CM分化模型中的ATAC-seq数据鉴定出了2891个可能的心肌细胞增强子区域,通过在hiPSC-CMs中进行lentiMPRA分析鉴定出1136个具有活性的心肌细胞增强子。

Fig 1. Functional disp of human cardiac enhancers by lentiMPRA in human iPSC-derived cardiomyocytes (hiPSC-CMs)
为了进一步解析这些增强子的特性,该团队选取lentiMPRA筛选到的top 123个增强子进行系统地10bp截断突变(10-bp tiling deletion mutagenesis MPRA)分析,鉴定出了大量影响增强子活性的突变体和关键转录因子结合位点(Fig 2)。
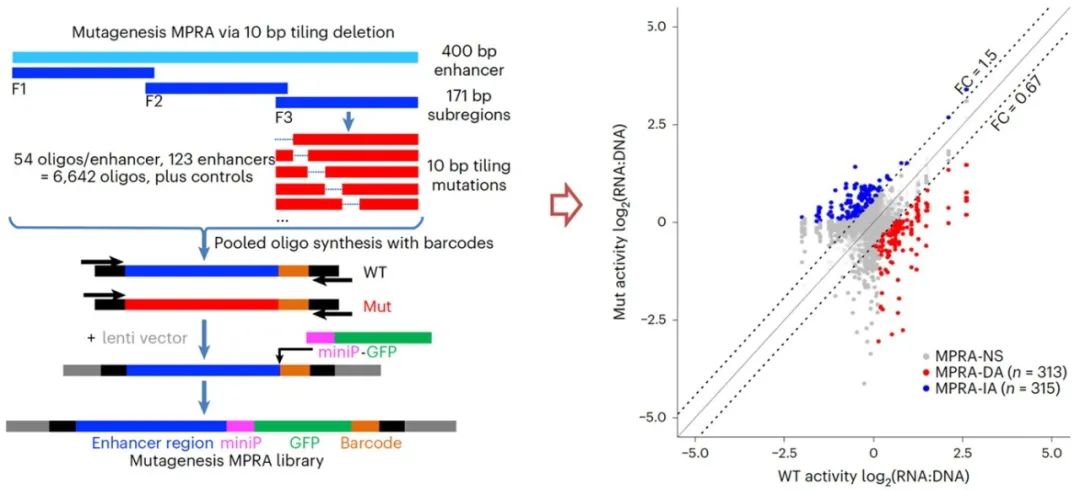
Fig 2. Analysis of human cardiac enhancers by 10-bp tiling deletion
接着,该团队通过对已发表的750个先心病家系的全基因组数据进行分析,借助生物信息分析的方法富集到了6590个与先心病相关的非编码区新生点突变(noncoding de novo variants, ncDNVs)。利用lentiMPRA对6590个ncDNVs进行分析评价,发现403个ncDNVs显著改变了增强子活性(Fig 3)。意外的是,53% ncDNVs增加了增强子的活性,这提示大约50%的点突变可能是通过增加增强子活性和上调靶基因表达而导致心脏发育异常。以往的研究主要集中在筛选降低增强子活性的点突变,而忽视了这一部分能增加增强子活性的突变。为了更好理解这些非编码区点突变如何影响增强子活性,该团队分析了403个点突变影响了哪些关键TF motif,发现这些点突变倾向于影响参与心脏发育的重要转录因子的结合,比如GATA、TBX、SRF、TEAD、SMAD等。
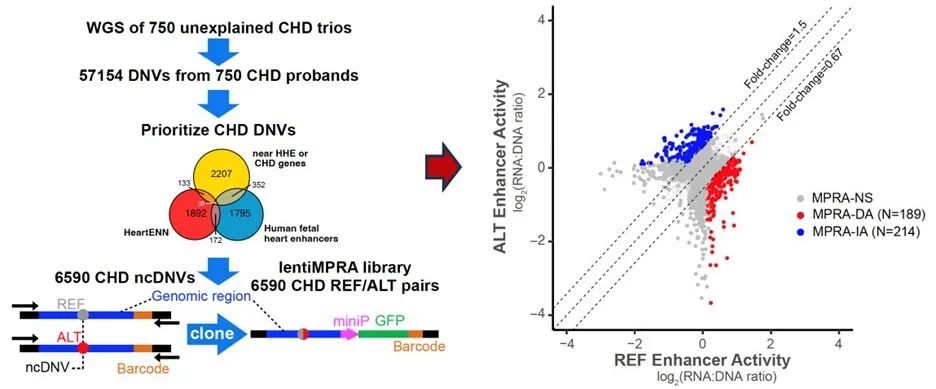
Fig 3. Functional disp of CHD ncDNVs for their impact on cardiac enhancer activity by lentiMPRA in hiPSC-CMs
由于这些非编码区点突变在动物模型中不保守,为了进一步揭示这些非编码区点突变如何影响心脏发育,该团队选择使用hiPSC-CM模型进行探究。他们选择了15个靠近已知的先天性心脏病基因的点突变,包括10个影响MPRA活性(MPRA-DA、MPRA-IA)和5个不影响MPRA活性(MPRA-NS)的点突变。利用CRISPR/Cas9系统分别将它们敲入(knock-in, KI)人iPS细胞,建立点突变KI细胞系,并将这些细胞系分化成心肌细胞。接着,利用RT-qPCR分析这些点突变对临近基因表达的影响,发现4个点突变显著改变了靶基因的表达,其中2 个点突变分别降低了BCOR和MYOCD的表达,2个点突变分别增加了ADAMTS6和GALNT6的表达(Fig 4b-e)。对这4个点突变KI细胞系来源的心肌细胞进行单细胞测序分析,发现这4个点突变不仅改变了靶基因的表达,而且显著改变了心肌细胞类群的状态和比例(Fig 4f-h)。相反,5个不影响MPRA活性的点突变(阴性对照),则没有显著影响hiPSC-CM分化。以上结果为非编码区点突变如何影响基因表达和心脏的发育提供了直接证据。
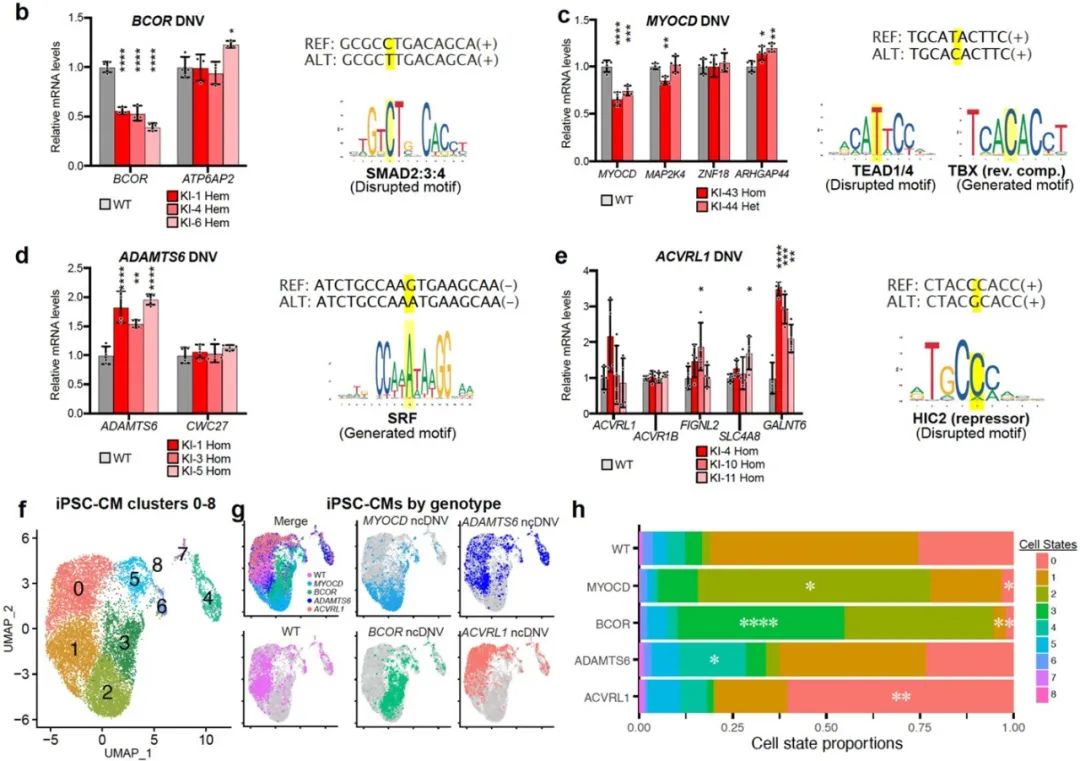
Fig 4. Interrogation of CHD ncDNVs for their impact on CHD gene expression and hiPSC-CM differentiation
综上,该研究利用lentiMPRA和hiPSC-CM模型建立了一个高通量评价人心肌细胞增强子活性的方法,并利用这一方法首次大规模解析了先天性心脏病中的非编码区点突变对人心肌细胞增强子活性的影响。此外,该研究对筛选到的非编码区点突变进行了原位敲入验证和单细胞测序分析,首次揭示了非编码区点突变如何影响人类心肌细胞分化,为先天性心脏病的发病机制提供了新的解释,将有助于提高先心病的早期筛查、诊断和治疗。此外,在hiPSC分化来源的其他细胞类型中进行lentiMPRA实验,可用于筛选与其他疾病相关的非编码区点突变,具有广泛的应用前景。
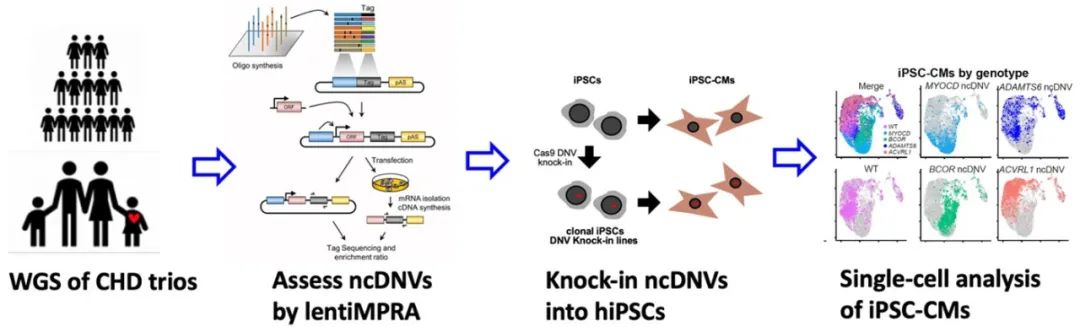
Fig 5. Schematic of the strategy functionally dissecting ncDNVs in congenital heart disease
哈佛大学医学院/波士顿儿童医院William Pu实验室的博后肖峰和张晓然、哈佛大学医学院Christine Seidman实验室的博后Sarah Morton(现为哈佛医学院助理教授)为共同第一作者。William Pu教授和美国科学院院士/HHMI研究员Christine Seidman为共同通讯作者。此外,哈佛大学医学院Jonathan Seidman院士和Seong Won Kim博士、山东第一医科大学附属省立医院范右飞教授、哈佛大学医学院/Dana-Farber 癌症研究所的张焕博士等对本研究做出了重要贡献。
可分享全文链接:
https://rdcu.be/dy7i9