巨噬细胞是单核吞噬细胞系统的重要细胞群,在宿主防御中发挥重要作用,包括识别和清除病原体,通过分泌细胞因子、酶等因子塑造炎症反应,并作为抗原提呈细胞调节适应性免疫反应。肿瘤中浸润的巨噬细胞,被称为肿瘤相关巨噬细胞(TAMs)。TAMs是肿瘤微环境(TME)中最丰富和最具可塑性的肿瘤浸润性免疫细胞,来自临床和基础研究的数据显示TME中的TAMs多为促肿瘤的M2表型,在促进肿瘤进展、转移和治疗抵抗中起着至关重要的作用。同时,M2 TAMs在促进肿瘤免疫抑制和免疫逃逸中的作用直接或者间接的限制了目前很多肿瘤免疫治疗策略的疗效。因此,TAMs已经成为肿瘤免疫治疗的重要靶点,针对TAMs的免疫治疗策略主要包括(1)抑制TAMs的招募;(2)在TME清除TAMs;(3)将M2 TAMs重编程为M1 TAMs。考虑到TAMs在TME中的丰度和可塑性,将TAMs从促肿瘤M2表型重编程为抗肿瘤M1表型是一种更有前景和潜力的肿瘤免疫治疗策略,然而,开发一种有效的策略仍然具有挑战性。
近日,中国医学科学院/北京协和医学院马雁冰研究员在《ACS Nano》期刊在线发表了题为“Engineered Bacterial Biomimetic Vesicles Reprogram Tumor-Associated Macrophages and Remodel Tumor Microenvironment to Promote Innate and Adaptive Antitumor Immune Responses”的研究论文。

本文要点
该研究设计并制备了一种表面高表达IFN-γ的细菌仿生囊泡(BBV)。IFN-γ在BBV表面的荷载量高达39.7%,远远高于工程化细菌自然释放的细菌外膜囊泡(OMVs)表面的IFN-γ含量,同时IFN-γ BBV具有纳米化的脂质结构并保留了亲本细菌来源的病原相关分子模式(PAMPs)。
在体外BMDMs和Raw264.7细胞重编程实验中,通过转录组测序和信号通路验证,显示IFN-γ BBV利用表面暴露的IFN-γ和PAMPs激活JAK-STAT和NF-κB信号通路,将M2表型的巨噬细胞(高表达CD206)重编程为M1表型(高表达CD86),上调诱导型一氧化氮合成酶(iNOS)和MHC分子的表达,并分泌促炎性细胞因子和趋化因子,释放一氧化氮(NO)杀伤肿瘤细胞。
紧接着,该团队分别在TC-1宫颈癌和CT26结肠癌荷瘤小鼠评估IFN-γ BBV的抗肿瘤效应。一方面,IFN-γ BBV利用其高效的肿瘤靶向能力,静脉注射后成功地将M2 TAMs重编程为M1 TAMs,并释放NO直接杀死肿瘤细胞;另一方面,作为抗原递呈细胞,重编程后的M1 TAMs通过对肿瘤细胞的吞噬和抗原呈递,将肿瘤抗原通过MHC分子呈递给T细胞,协同巨噬细胞释放的IL-12促进TME中的抗原特异性的细胞毒性T淋巴细胞(CTL)反应,并抑制免疫抑制性髓源性抑制细胞(MDSC)的反应,下调了调节性T细胞(Tregs)的比例,促进了肿瘤细胞的凋亡,重塑了肿瘤免疫抑制微环境,最终显著抑制肿瘤的生长。
重要的是,体内巨噬细胞耗竭实验显示IFN-γ BBV的抗肿瘤作用显著依赖于巨噬细胞。在体内巨噬细胞耗竭之后,IFN-γ BBV诱导的针对肿瘤新抗原的Th反应和CTL反应显著下调,对肿瘤生长的抑制作用减弱。这些数据表明IFN-γ BBV的抗肿瘤作用和引发的CTL反应极大程度是巨噬细胞介导的。此外,原位4T1乳腺癌模型作为一种对免疫检查点抑制剂不敏感的“冷”肿瘤,通过IFN-γ BBV对肿瘤免疫抑制微环境的重塑后,使得4T1乳腺癌对PD-1mAb治疗敏感,这种组合式的治疗能够显著抑制原位乳腺癌的生长和转移。
总的来说,凭借其表面暴露的IFN-γ和PAMPs,IFN-γ BBV具有强大的TAMs重编程能力,可重塑TME,将“冷”肿瘤转变为“热”肿瘤,促进固有免疫和适应性的抗肿瘤免疫,为肿瘤免疫治疗提供了一种有效的途径。
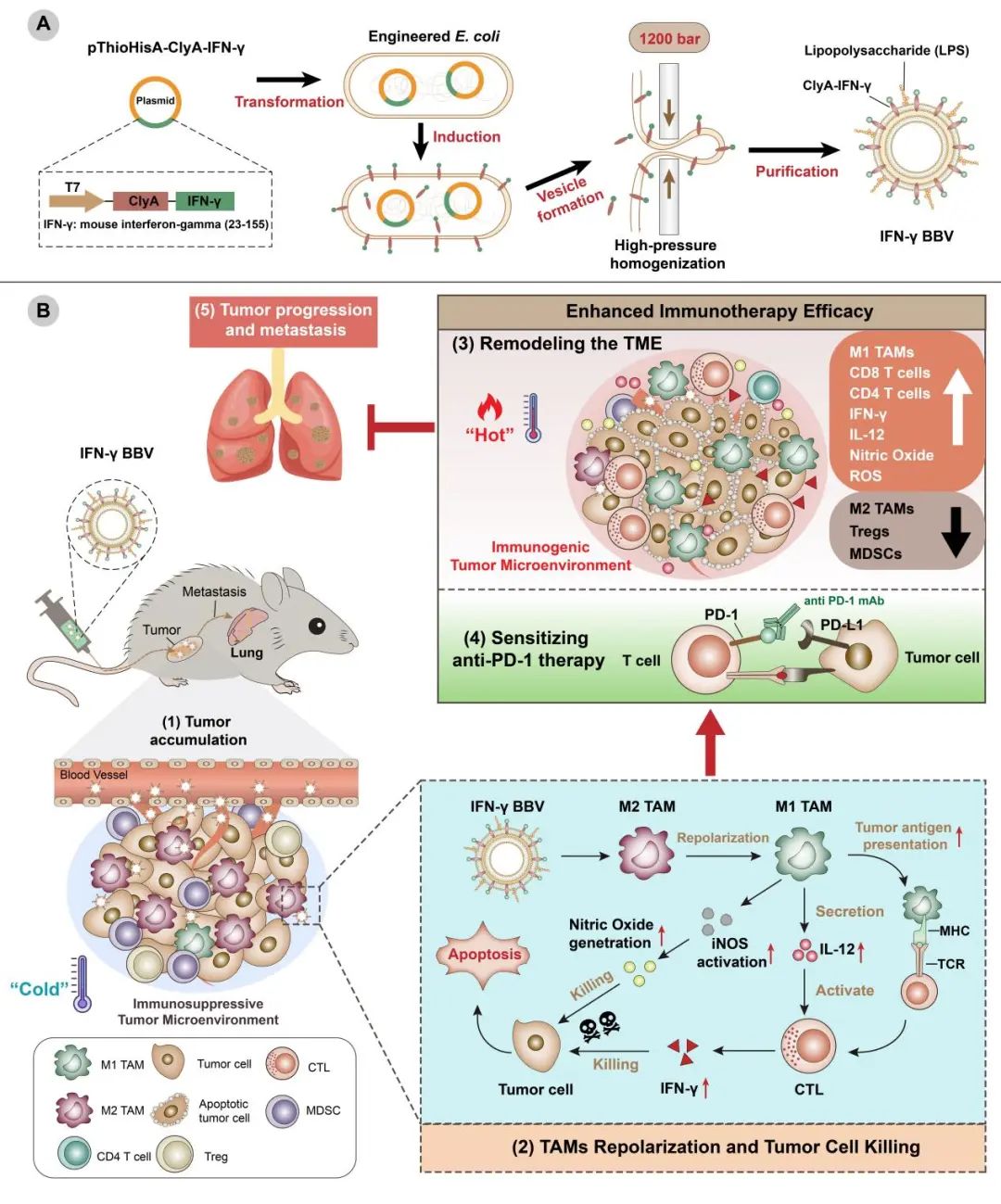
图1 工程化的细菌仿生囊泡重编程TAM重塑肿瘤微环境和促进抗肿瘤反应的示意图
原文链接:
https://pubs.acs.org/doi/full/10.1021/acsnano.3c06987