肿瘤免疫治疗可以特异性地激活患者自身免疫系统去识别并杀死肿瘤细胞,有望实现癌症治愈。例如,免疫检查点阻断(ICB)和嵌合抗原受体T细胞(CAR-T)治疗已显示出显著的临床疗效,但是只有一小部分患者表现出良好的治疗效果,这主要归因于“冷”的肿瘤微环境、肿瘤免疫原性低和抗原呈递效率差等。肿瘤疫苗能够正向激活机体免疫系统,促进抗原交叉呈递,产生特异性地抗肿瘤免疫反应。在肿瘤疫苗中佐剂能够有效提高抗原呈递效率,在肿瘤免疫治疗中发挥着至关重要的作用。目前FDA批准的铝佐剂只能激活体液免疫,不能激活细胞免疫,且作用机制尚不清楚,限制了临床应用。近些年来开发的小分子Toll样受体(TLR)激动剂能够激活免疫和非免疫细胞上表达的跨膜受体家族,作用机制相对明确。其中,TLR7激动剂咪喹莫特(R837)与其他TLR激动剂相比,具有以下特点:(1)特异性高;(2)FDA批准且安全性和耐受性良好;(3)特异性激活细胞和体液免疫。然而,R837疏水性强,且作用靶点位于内涵体或溶酶体的内膜上,因此,全身给药容易引起过度免疫或脱靶效应,如头痛,甚至细胞因子风暴等。
纳米递药药系统可以提高难溶性药物的溶解度,控制药物释放和改变药物体内分布。但是,目前TLR激动剂的主要递送策略仍然存在药物包封率低(物理载药)和影响药物活性(化学偶联)的问题。因此,在高效递送 TLR激动剂的同时保持药物的活性仍然面临挑战。
近期,西北工业大学刘德春副教授等人报道了利用质子浓度驱动高效负载R837的光敏脂质体作为原位纳米佐剂用于协同增效光免疫治疗。相关工作以“Proton-Gradient-Driven Porphyrin-Based Liposome Remote-Loaded with Imiquimod as In-situ Nano-adjuvants for Synergistically Augmented Tumor Photoimmunotherapy”为题发表在ACS Applied Materials & Interfaces。

首先通过pH梯度法成功将R837负载到光敏脂质体的内水相中,R837在酸性内涵体/溶酶体微环境中快速释放,激活内涵体/溶酶体内膜的TLR,促进抗原提呈细胞(BMDCs)成熟,诱导抗原交叉呈递(图1和2)。

图1. 负载R837光敏脂质体的制备与表征。

图2. 负载R837光敏脂质体对4T1细胞免疫原性调节和BMDCs活化的影响。
体内研究结果显示光动力效应能够触发肿瘤细胞免疫原性细胞死亡和肿瘤相关抗原释放,与R837联合形成原位纳米疫苗,促进BMDCs成熟,并有效地将肿瘤相关抗原和佐剂递送到肿瘤引流淋巴结中。负载R837光敏脂质体在激光照射下能显著抑制光照侧和远端肿瘤的生长,显示出良好的光免疫治疗效应(图3)。
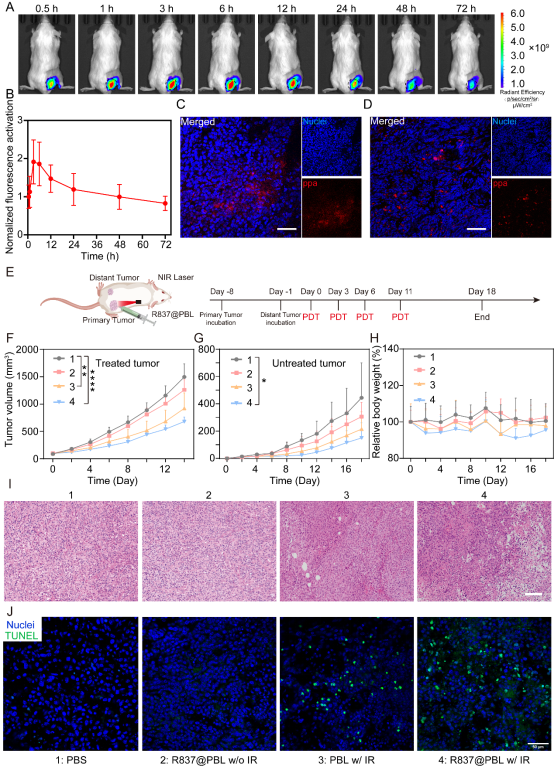
图3. 皮下注射负载R837光敏脂质体体内分布和抗肿瘤药效。
综上所述,免疫佐剂高效和高载量共递送策略为肿瘤纳米佐剂设计和协同增效光免疫治疗效应提供了新的思路(图4)。
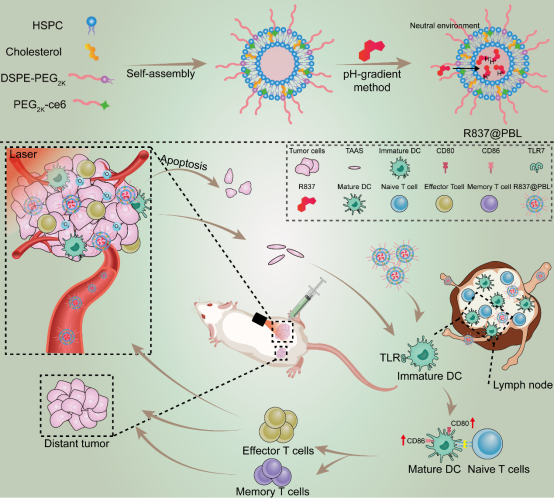
图4. 负载R837光敏脂质体原位纳米佐剂的设计和作用机理示意图。
西北工业大学刘德春副教授和陕西科技大学杨丹副教授为本研究论文的共同通讯作者。该工作得到了国家自然科学基金、陕西省重点研发计划、陕西省创新能力支撑计划和中央高校基本科研业务费等基金的资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acsami.3c17133