阿尔兹海默症(AD)已被广泛研究,因此想要取得新的突破不能拘泥于现有的科研思路,而需要“拓宽眼界”。CD8+T细胞是免疫系统研究中的热门细胞之一,已有研究表明,AD患者脑内存在CD8+T细胞扩增,但具体机制未知。那么,二者在新模型的加持下进行碰撞,又会得到怎样的惊喜?
近日,哈佛大学医学院相关研究团队在Nature neuroscience杂志发表研究成果[1]——首次构建了一个3D人体神经免疫轴模型,用来研究AD的病理以及免疫细胞和神经细胞之间的相互作用,为AD免疫细胞浸润的分子机制提供了新的见解。

一、研究内容与思路
1、构建AD患者神经免疫轴三维模型—外周免疫芯片系统(PiChip)
为了评估外周血单个核细胞(PBMC)的浸润及其与脑驻留细胞的相互作用,作者使用微流控技术开发了一种3D人神经免疫轴模型-外周免疫芯片(PiChip)系统。
PiChip系统支持多细胞培养,包括AD患者/人神经元(Neu)、星形胶质细胞(ACs)、干细胞衍生的小胶质细胞(iMGLs)和PBMC。收集细胞和培养基,进行生化检测、免疫染色和单细胞测序,利用延时共聚焦成像技术监测PBMC的浸润情况。多种数据表明,PiChip系统概括了AD的主要病理特征。
实验结果发现,AD中ACs细胞相关差异基因表达显著增加;而通路分析显示,AD神经元与内质网应激、DNA损伤和INF-γ相关的通路显著增加;GO分析显示,AD中Acs细胞与信使RNA稳定性、tau激酶和细胞应激反应调控相关的几种通路均显著上调。
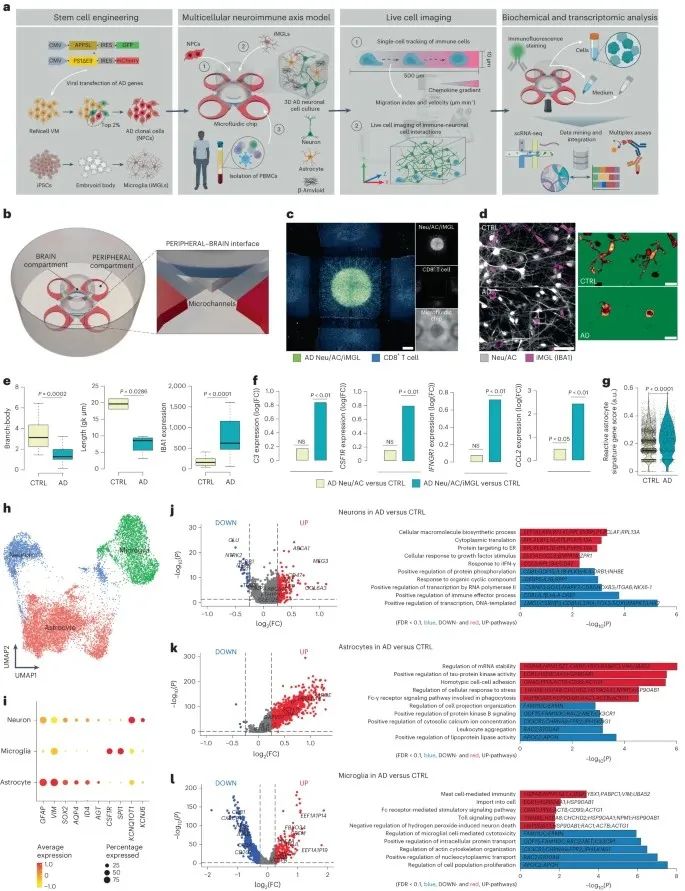
研究思路:通过文献探索发现,在AD领域中,AD患者脑内存在CD8+T细胞扩增,但具体机制未知。于是,作者构建了一个全新的模型来进行探索——构建了AD患者神经免疫轴三维模型—外周免疫芯片系统(PiChip),并验证表明这个模型符合AD病理,为后续研究铺定基础。
2、T细胞选择性浸润到AD细胞模型和5xFAD小鼠中
作者探索了PiChip系统中AD神经病理学的存在是否会影响PBMC向AD神经胶质培养物进行定向迁移。结果发现,相比于空白对照组(CTRL组),AD培养组中的CD3+T、CD4+T、CD8+T或单核细胞浸润增加、迁移速度增快,而B细胞浸润减少,迁移速度不变。进一步发现,当小胶质细胞存在时,AD培养物中CD3+T细胞浸润依然增加,但迁移速度与CTRL组相似,但单核细胞和B细胞浸润减少,且迁移速度减慢。
作者采用动物实验来验证上述所得结论,发现在1.5个月开始出现AD病理的5×FAD小鼠中,脑内血管外CD4+T和CD8+T细胞的数量显著增加,与在人类PiChip系统中所得结果一致。
研究思路:模型构建成功后,作者分析了T细胞和小胶质细胞在AD细胞模型与AD小鼠中的表达情况,具体到T细胞种类。
3、浸润的CD8+T细胞与小胶质细胞相互作用来加剧AD神经退行性变
进一步使用PiChip系统评估浸润T细胞对AD发病机制的影响以及小胶质细胞在这一过程中的作用,结果发现,AD培养物中浸润性CD3+T细胞和小胶质细胞都会导致细胞损伤,且小胶质细胞的存在会进一步加剧细胞损伤。
为了深入分析何种类型的T细胞与神经退行性变相关,作者测试了CD4+和CD8+T细胞,发现主要是CD8+T细胞发挥的作用。单独的浸润CD8+T细胞会导致神经元损伤,与小胶质细胞同时存在会导致细胞与神经元都受到损伤,表明二者协同加剧了AD培养物中的神经退行性变。
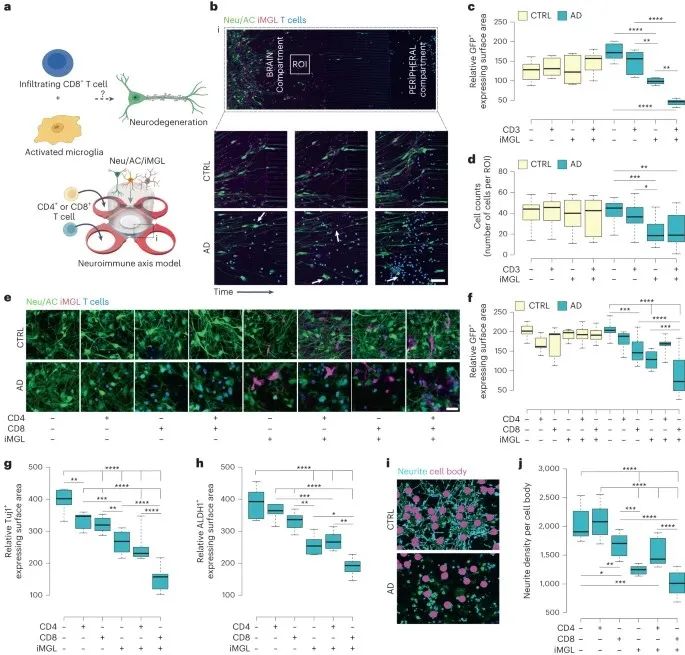
研究思路:那T细胞与小胶质细胞在AD中是否存在协同作用,以及是哪种T细胞发挥主要作用。
4、AD培养物中T细胞浸润后,神经胶质细胞中的干扰素(IFN)/炎症相关通路被激活
进一步,作者探索了浸润T细胞对AD或CTRL培养物中小胶质细胞基因表达的影响,发现含有小胶质细胞的AD培养物中CD8+T细胞比例增加,但T细胞的存在则会导致小胶质细胞数量减少,表明T细胞调节小胶质细胞,而小胶质细胞可以作为抗原呈递细胞来促进T细胞浸润。
作者对系统中的T细胞和小胶质细胞进行了单细胞测序,发现与CTRL组相比,小胶质细胞在T细胞浸润的AD培养物中生长后,有263个基因表达上调,82个基因表达下调。GO分析发现,参与与IFN-γ介导的信号通路、通过MHC-I抗原加工和呈递以及淀粉样蛋白纤维形成的基因显著上调;参与细胞对细胞因子刺激的反应、凋亡细胞清除相关通路等基因显著下调。
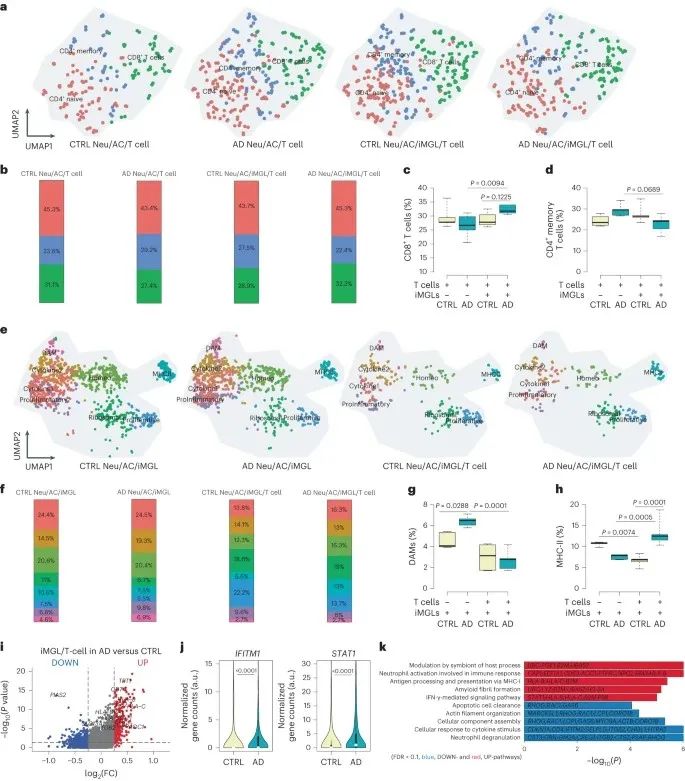
研究思路:明确了CD8+T细胞与小胶质细胞协同作用后,作者进一步探索了二者之间是否存在互相调节关系。此外,二者协同作用后究竟是哪些基因发生了改变。
5、CXCL10在AD神经免疫轴模型和5×FAD小鼠脑中上调
接下来,作者鉴定了调节T细胞浸润到AD培养物中的细胞因子或趋化因子。发现不管是否存在小胶质细胞,AD培养物中的趋化因子CXCL10均显著增加。采用单细胞RNA测序发现与CTRL组相比,AD培养物中的CXCL10高度富集。对此,作者探索了CXCL10是否调节T细胞募集,发现高水平的CXCL10可以显著诱导CD4+和CD8+T细胞向AD培养物的趋化迁移,且对CD8+T的影响更明显。
之前的研究表明,CXCL10通过与CXCR3结合诱导T细胞趋化性。对此,作者发现在5×FAD小鼠海马跟皮层中,CXCR3与CD8+T细胞存在共定位,且相比于其他T细胞亚群,CD8+T细胞中CXCR3表达水平增多。同时,5×FAD小鼠海马和皮质CXCL10水平均显著升高,并与AC标志物GFAP存在共定位。
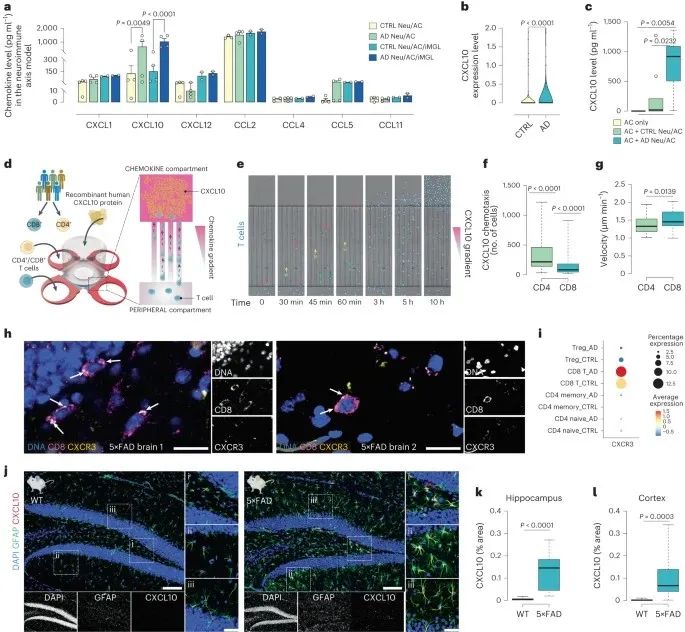
研究思路:明确了发挥作用的细胞类型后,下一步便是探索细胞是如何发挥作用来影响AD病理的了。根据测序结果以及现有的文献,研究者将研究目标锁定在了细胞因子和趋化因子上,发现了CXCL10。实验验证表明,CXCL10-CXCR3在这一环节中存在重要作用。
6、抑制CXCL10与CXCR3结合可减弱CD8+T细胞浸润和神经退行性变
作者探索阻断CXCL10-CXCR3轴是否会减少CD4+或CD8+T细胞浸润到AD培养物中,发现在人血液样本中,绝大多数CD8+T细胞表达CXCR3,且表达显著高于CD4+T细胞。
采用CXCR3中和抗体MAB160处理后,CXCR3在CD4+和CD8+T细胞中的表达减少,且CD4+T及CD8+T细胞浸润减少、神经元损伤减少、神经元数量增加,表明CXCL10-CXCR3轴在介导T细胞浸润及其在AD中的致病作用。
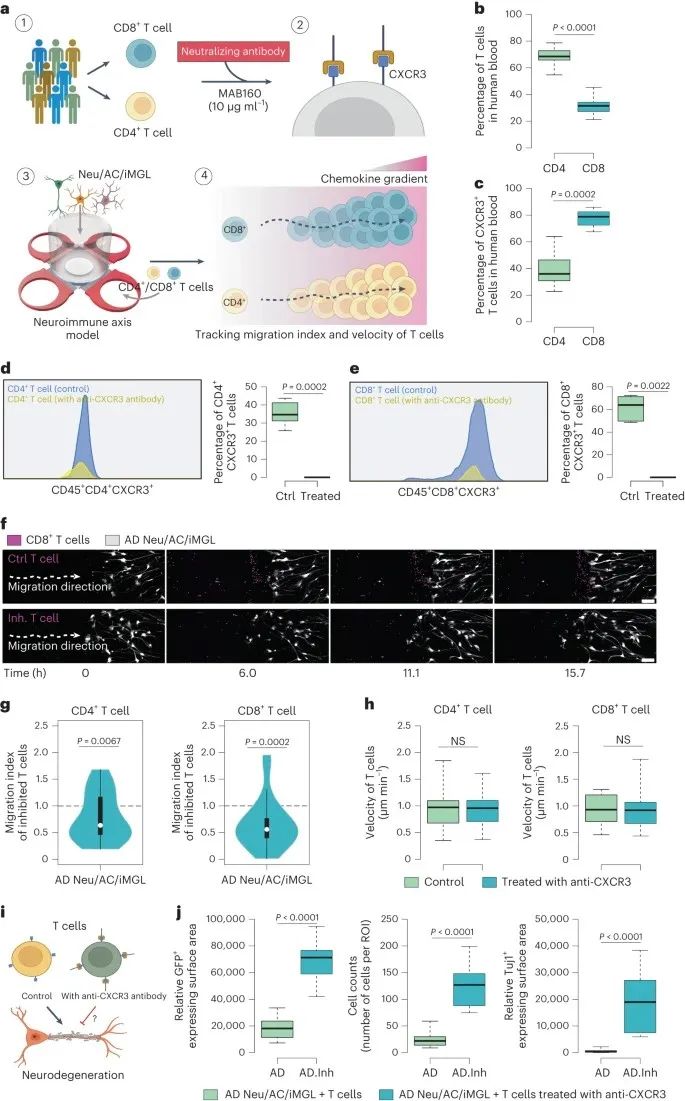
研究思路:正向研究思维发现CXCL10-CXCR3的重要作用后,作者抑制了这一通路的表达,从而探索T细胞浸润与小胶质细胞对AD的影响,发现影响作用被削弱,从反向研究思维出发,证明了CXCL10-CXCR3的重要。
二、研究小结
文章的主要创新之处在于:作者构建了一个新的模型(PiChip系统)来探索浸润性CD8+T细胞在AD中的作用,这个新模型可以用来探索AD细胞、干细胞衍生的神经元、星形胶质细胞、小胶质细胞和T细胞之间的相互作用,较为完整的模拟了AD病理环境。此外,作者还使用AD动物模型来进一步佐证所得结果,使得实验结果更可靠。这一研究结果为AD免疫细胞浸润及其相关分子机制提供了新的见解及研究思路。
参考文献:
[1] Jorfi, Mehdi et al. “Infiltrating CD8+ T cells exacerbate Alzheimer's disease pathology in a 3D human neuroimmune axis model.” Nature neuroscience vol. 26,9 (2023): 1489-1504. doi:10.1038/s41593-023-01415-3